
【題目】工業上利用生產鈦白的副產品硫酸亞鐵制備還原鐵粉的流程如圖
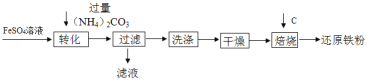
下列說法不正確的是
A. “轉化”時在溶液中生成了FeCO3沉淀,該反應的基本反應類型是復分解反應;
B. “過濾”后得到的濾液中的溶質只有(NH4)2SO4;
C. “干燥”過程中有少量的FeCO3轉化為FeOOH和CO2,此時與FeCO3反應的物質有O2和H2O;
D. 取14.06g還原鐵粉(僅含有Fe和少量FexC)在氧氣流中充分加熱,得到0.22gCO2,另取相同質量的還原鐵粉與足量稀硫酸充分反應(FexC與稀硫酸不反應),得到0.48gH2,則FexC的化學式是Fe3C。
【答案】BD
【解析】
硫酸亞鐵和碳酸銨反應生成碳酸亞鐵沉淀和硫酸銨,由于碳酸銨過量,過濾后得到的濾液中的溶質有硫酸銨和碳酸銨,通過洗滌干燥,少量的![]() 轉化為
轉化為![]() 和
和![]() ,碳將氧化鐵轉化為還原性鐵粉。
,碳將氧化鐵轉化為還原性鐵粉。
A、硫酸亞鐵和碳酸銨反應生成碳酸亞鐵沉淀和硫酸銨,“轉化”時在溶液中生成了![]() 沉淀,反應符合兩種化合物相互交換成分,則該反應的基本反應類型是復分解反應,故A正確,不符合題意;
沉淀,反應符合兩種化合物相互交換成分,則該反應的基本反應類型是復分解反應,故A正確,不符合題意;
B、由于碳酸銨過量,過濾后得到的濾液中的溶質有硫酸銨和碳酸銨,故B不正確,符合題意;
C、 “干燥”過程中有少量的![]() 轉化為
轉化為![]() 和
和![]() ,此時與
,此時與![]() 反應的物質有
反應的物質有![]() 和
和![]() ,故C正確,不符合題意;
,故C正確,不符合題意;
D、0.22g二氧化碳中所含碳元素的質量為![]() ,設生成0.48g氫氣需要單質鐵的質量為a
,設生成0.48g氫氣需要單質鐵的質量為a
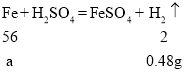
![]()
![]()
則![]() 中鐵元素的質量為
中鐵元素的質量為![]() ,
,![]() 中鐵、碳元素的質量比為
中鐵、碳元素的質量比為
![]() ,則
,則![]() ,則
,則![]() 的化學式為
的化學式為![]() ,故D不正確,符合題意。故選BD。
,故D不正確,符合題意。故選BD。


科目:初中化學 來源: 題型:
【題目】如圖所示是A、B、C三種固體物質的溶解度曲線圖。

(1)甲圖中,t2℃時A、B、C三種物質中溶解度最大的是__________。P點所表示的含義是___________。
(2)t2℃時,將等質量的A、B、C三種物質溶解形成飽和溶液,所得溶液質量最大的是__________(填“A”或“B”或“C”)
(3)如乙圖所示,20℃時,把試管放入盛有X的飽和溶液的燒杯中,在試管中加入幾小段鎂條,再加入5mL稀鹽酸,立即產生大量的氣泡,同時燒杯中出現渾濁,則X可能為A、B、C三種固體物質中的哪一種__________?
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】用圖所示裝置研究二氧化碳的性質。其中,①、④為用紫色石蕊溶液潤濕的棉球,②、③為用石蕊溶液染成紫色的干燥棉球。
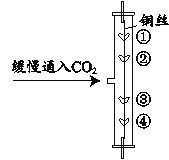
(1)說明CO2密度大于空氣的實驗現象為_____;除此之外,該實驗還能研究的二氧化碳的性質是_____。
(2)某同學將變紅了的棉球用吹風機烘干后,觀察到棉球又變回紫色。但是,他認為此現象不足以說明“碳酸受熱發生化學反應”,理由是_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某化學興趣小組的同學們在實驗室里探究某些酸、堿、鹽之間是 否發生復分解反應。
(查閱資料)硫酸鋇(BaSO4)白色固體,不溶于水,也不溶于酸。
(實驗與探究)
操作 | 現象 | 實驗解析 | 結論 | |
實驗一 |
| ①________ | 化學方程式是: K2CO3+H2SO4=K2SO4+H2O+CO2↑ | 生成物中 有氣體或 有④____ 或有沉淀 生成時, 復分解反 應可以發 生。 |
實驗二 | 適量的稀硫酸
| 溶液顏色 由紅色恰 好變為無 色 |
| |
實驗三 |
| 產生白色 沉淀 | 該反應的實質是:Ba2++SO42-=BaSO4↓ |
實驗三結束后,某同學出于好奇,把實驗三試管里的上層清液 a 倒入另一支潔凈的試管中,向清液 a 中逐滴滴加 K2CO3 溶液。在滴加過程中,發現先產 生氣泡,然后又產生白色沉淀。根據上述現象,請你判斷原清液 a 中的溶質是⑤______。
(拓展)將稀鹽酸、Ca(OH)2 溶液、NaCl 溶液、Na2CO3 溶液任意兩種溶液相 混合,寫出能發生反應且有沉淀生成的化學方程式______。
(反思)復分解反應的實質是朝著單位體積內______(填微粒種類 名稱)數目減小的方向進行。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】A、B、C、D、E、F分別是由兩種或三種元素組成的常見化合物。B是人類利用最廣泛的一種氧化物,生活中可用來滅火;D廣泛用于玻璃、造紙、紡織、洗滌劑的生產;人體胃酸中含有F,可幫助消化。它們之間的一部分關系如圖所示,(圖中“﹣”表示兩端的物質能發生化學反應;“→”表示物質間存在轉化關系。部分反應物或生成物已略去)請回答下列問題:
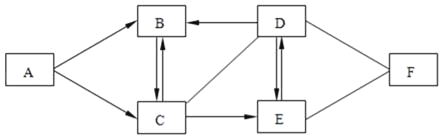
(1)B物質的化學式為_____;F物質的化學式為_____。
(2)C與D反應的基本反應類型是_____
(3)D→E反應的化學反應方程式為_____。
(4)A→C反應的化學反應方程式為_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】銅及其化合物在生產、生活中都有廣泛的應用。
一、銅的冶煉
資料一:考古工作者從安陽的商代鑄銅遺址中,發現當時冶煉銅的主要礦物原料是孔雀石[主要成分是堿石碳酸銅Cu2(OH)2CO3],主要燃料是木炭,冶煉溫度估計在1000℃左右。
資料二:西漢劉安著《淮南萬畢術》中記載“曾青得鐵則化為銅”。“曾青”可能是硫酸銅一類的物質,將孔雀石溶于硫酸中得此溶液,當把鐵粉投入此溶液中即可得銅。
(1)關于“曾青”和孔雀石的說法中,正確的是___。
A 前者屬于鹽,后者的主要成分是堿 B 前者屬于酸,后者的主要成分是堿
C 前者和后者的主要成分都屬于氧化物 D 前者和后者的主要成分都屬于鹽
(2)以孔雀石為原料的冶煉過程中,用現代化學的觀念審視,可能涉及的化學反應有__。
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O ②2CuO+C
2CuO+CO2↑+H2O ②2CuO+C![]() 2Cu+CO2↑
2Cu+CO2↑
③CuO+CO![]() Cu+CO2 ④CO2+C
Cu+CO2 ④CO2+C![]() 2CO
2CO
A ①② B ①③ C ①②③ D ①②③④
(3)已知有元素化合價升高和降低的反應屬于氧化還原反應。在(2)的四個反應中,不屬于四種基本反應類型的有(填序號,下同)____,不屬于氧化還原反應的有____。
(4)資料二中,假設溶解孔雀石的酸是稀硫酸,寫出用此方法冶煉銅的化學方程式:___,___。
二、銅及其化合物的應用
(5)堿式碳酸銅是一種具有廣泛用途的化工產品,主要用于固體熒光粉激活劑和銅鹽的制造等。堿式碳酸銅由Na2CO310H2O與CuSO45H2O反應制備,原理:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2Na2SO4+CO2↑。稱取14.0gCuSO45H2O、16.0gNa2CO310H2O,用研缽分別研細后再混合研磨,立即發生反應,有“嗞嗞”聲,而且混合物很快成為“黏膠狀”。將混合物迅速投入200mL沸水中,快速攪拌并撤離熱源,有藍綠色沉淀生成,過濾,用水洗滌,至濾液中不含SO42﹣為止,取出沉淀,風干,得到藍綠色晶體。
①混合物發生反應時有“嗞嗞”聲的原因是___。
②撤離熱源的目的是___。
組成測定:
有同學查閱資料發現用Cu(OH)2CuCO3表示堿式碳酸銅是不準確的,較為準確、科學的表達式是mCu(OH)2nCuCO3,不同來源的堿式碳酸銅的m、n值需要具體測定。熱分解法測定堿式碳酸銅組成的實驗裝置如下圖所示,通過測定堿式碳酸銅在灼熱后所產生的氣體體積,推導出堿式碳酸銅中碳酸銅和氫氧化銅的含量,即可求出m和n的比值。
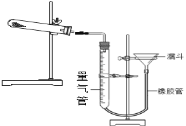
③三次平行實驗測定結果如下表,則該樣品中m:n=___,若量氣管中所盛液體是水,則該測定值比理論值___(填“偏大”、“偏小”或“不變”)。(已知該狀況下,二氧化碳密度為1.964g/L)
實驗序號 | 樣品質量/g | CO2體積/mL (已折算成標準狀況下) |
1 | 0.542 | 44.82 |
2 | 0.542 | 44.80 |
3 | 0.542 | 44.78 |
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】水是常用的溶劑,請根據圖一實驗現象和圖二的甲、乙溶解度曲線回答下列問題:
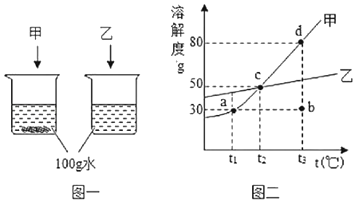
(1)圖一實驗,若探究甲、乙的溶解性的同時還想硏究甲、乙兩種物質分別溶于水過程中的熱量變化,請你重新設計實驗,簡述實驗操作_____。
(2)①t1℃時,甲物質的溶解度是_____g;
②圖二中,甲物質的四種溶液狀態“a、b、c、d”中,處于不飽和狀態的是_____(填編號);
③t1℃時,將l5g甲加入到_____g水中,完全溶解后,恰好得到飽和溶液;為了進一步提高該溶液的溶質質量分數,可進行的操作是_____;
④取甲、乙的混合物100g溶于100g熱水,待冷卻到t2℃,若甲析出而乙不析出,則混合物中甲的質量分數ω的取值范圍是_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】2019年蘇州市初中化學實驗考查內容是“用高錳酸鉀制取氧氣”(裝置圖如下),下面是某同學在本次實驗過程中填寫的部分實驗報告,請回答有關問題:
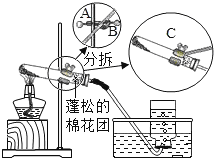
實驗步驟 | 有關問題 |
⑴檢查氣體發生裝置的氣密性。 | 檢查裝置氣密性的具體操作及氣密性良好的判斷依據是_____。 |
⑵向試管中加入少量高錳酸鉀粉末,使其平鋪于試管底部,按上圖所示組裝實驗裝置。在接近試管口的地方放置一小團蓬松的棉花團。 | ①用藥匙或紙槽向試管中加入少量高錳酸鉀粉末。 ②組裝實驗裝置時,要根據___的高度將盛有藥品的試管固定在鐵架臺上。 ③欲調整裝置中試管的傾斜角度,應調節圖中A、B、C哪個旋鈕:___旋鈕。 ④試管口棉花團的作用是____。 |
實驗步驟 | 有關問題 |
⑶加熱試管,當導管口有連續均勻氣泡冒出時,開始收集氣體。 | ①加熱試管的方法是____。 ②發生反應的化學方程式為____。 ③收集滿瓶氧氣的操作過程是:等集氣瓶中的水排完后,一只手扶穩集氣瓶,另一只手首先小心地將導管從瓶口移開,然后___,最后把集氣瓶正放在桌子上。 |
⑷氣體收集完畢后,操作B | 操作B是先____,再_____ |
⑸收集完氣體后,測得其純度明顯偏低,其原因可能是____(填字母)。
A 高錳酸鉀中混入了二氧化錳 B 收集前,集氣瓶中未注滿水
C 收集后,集氣瓶中仍留有水 D 未見氣泡連續均勻冒出時就開始收集
⑹選擇排水法收集一瓶氧氣,供“鐵絲在氧氣中燃燒”實驗使用的理由是____。
⑺)加熱3.16g高錳酸鉀固體一段時間,若高錳酸鉀中的氧元素有1/4轉化為氧氣,則生成的氧氣的質量為____,剩余固體中氧元素的質量分數為____。(精確到0.1%)
⑻林同學稱取一定質量高錳酸鉀制取一定質量的氧氣,將溫度控制在250℃加熱制O2,實驗結束時,林同學發現在用高錳酸鉀制取氧氣的實驗中,收集到的O2大于理論產量,針對這一現象,同學們在老師的指導下進行了如下探究:
(提出猜想)依據質量守恒定律,他們做出如下猜想:
猜想Ⅰ:反應生成的MnO2分解放出O2
猜想Ⅱ:反應生成的K2MnO4分解放出O2
(實驗驗證)同學們分為兩組,分別進行以下實驗:
①第一組同學取一定質量的MnO2,在250℃條件下加熱一段時間,冷卻后測得MnO2的質量不變。則猜想____錯誤。
②第二組同學取一定質量的K2MnO4在250℃條件下加熱,固體質量____(填“減輕”或“增重”),得出了猜想Ⅱ正確的結論。
林同學提出:不用測定質量也能驗證以上猜想是否正確,林同學選擇的實驗方法可能是____。
(拓展延伸)實驗發現,K2MnO4受熱只能部分分解,經分析可能是K2MnO4分解的生成物K2O對其分解產生影響。為驗證此結論,設計如下實驗方案:
①分別取K2MnO4固體于兩支試管中,一支試管中加入K2O,一支試管中不加K2O。
②加熱,用相同規格的集氣瓶,用排水法分別收集一瓶氣體。③比較所用的時間長短,以確定錳酸鉀的分解是否與氧化鉀有關系。該過程中還必須控制相同的變量是______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】水和溶液在生產生活中起著十分重要的作用。
(1)“直飲水機”可將自來水凈化為飲用水,其內部使用的活性炭主要起______作用。實驗室常用______方法降低水的硬度。
(2)C1O2是飲用水常用的消毒劑。制取C1O2的反應如下:C12+2NaC1O2=2C1O2+2X,則X的化學式為______。
(3)食鹽水能導電是由于食鹽溶于水形成______。
(4)如圖是甲、乙兩種不含結晶水的固體物質的溶解度曲線。
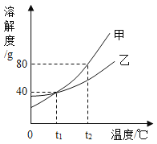
①t1℃時,甲物質的溶解度是_____g。
②t2℃時,若從甲和乙兩種物質的飽和溶液中析出等質量的固體,須蒸發掉較多水的是_____ (填“甲”或“乙”)物質的飽和溶液。
③t2℃時,將一瓶溶質質量分數為10%的乙溶液,蒸發掉60 g水后,溶質質量分數變為20%,則原溶液中溶質的質量為_____g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com