
【題目】鈦和鈦合金被認為是21世紀重要的金屬材料。鈦合金與人體具有很好的“相容性”,可用于制造人造骨骼。工業上以鈦鐵礦(主要成分為鈦酸亞鐵,FeTiO3)為原料生產鈦,其工業流程示意圖如下:
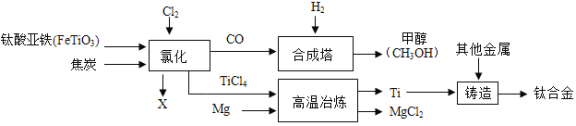
請回答:(1)鈦合金屬于_______(選填“混合物”、“純凈物”)。
(2)鈦酸亞鐵FeTiO4中鈦的化合價為______價。
(3)以CO和H2在合成塔中生產甲醇(CH3OH)屬于化合反應,其化學方程式為________________。
(4)經高溫冶煉得到金屬鈦,則參加反應的鎂與生成鈦的質量比為_________。
(5)氯化過程中主要發生的反應為2FeTiO3+6C+7Cl2![]() 2TiCl4+2X+6CO,則X的化學式為______。
2TiCl4+2X+6CO,則X的化學式為______。
【答案】混合物 +4CO+2H2=CH3OH1:1FeCl3
【解析】
(1)由兩種或兩種以上物質組成的物質叫混合物;由一種物質組成的物質叫純凈物;(2)化合物中元素的化合價的代數和為零,設鈦酸亞鐵FeTiO4中鈦的化合價為x,亞鐵指+2價的鐵元素,則x+(+2)+(-2)×4=0, x=+4;(3)由兩種或兩種以上物質生成一種物質的反應叫化合反應;以CO和H2在合成塔中生產甲醇(CH3OH)屬于化合反應,化學方程式為CO+2H2=CH3OH;(4)經高溫冶煉得到金屬鈦,TiCl4+2Mg═Ti+2MgCl2則參加反應的鎂與生成鈦的質量比為2×24:48=1:1;(5)據質量守恒定律可知,化學反應前后原子的種類、個數不變,反應前有6個氧原子、6個碳原子、 14個氯原子、2個鐵原子,反應后有有6個氧原子、6個碳原子、 14個氯原子、2個鐵原子,所以一個X的分子中有3個氯原子、1個鐵原子;X的化學式為FeCl3。


科目:初中化學 來源: 題型:
【題目】向MgO和CuO的混合物12g中加入稀硫酸至恰好溶解,再向所得溶液中加入NaOH溶液至恰好沉淀完全,生成Mg(OH)2和Cu(OH)2沉淀的總質量為15.6g,則參加反應的NaOH的質量為(已知MgO+H2SO4=MgSO4+H2O;MgSO4+2NaOH=Mg(OH)2↓+Na2SO4)
A. 3.6gB. 8.0 gC. 18.0gD. 16.0g
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】鋰在元素周期表中的信息如圖甲所示,圖乙表示某粒子的結構示意圖。下列說法正確的是( )
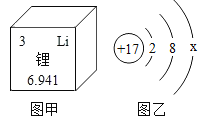
A. 由圖甲可知鋰的相對原子質量為6.941 g
B. 鋰原子核外有3個電子,金屬鋰能與O2反應生成Li2O3
C. x=8時,圖乙表示氯原子的結構示意圖
D. x=7時,圖乙所示原子容易得到一個電子形成Cl﹣
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某氯化鈣樣品中可能混有氯化鐵、氯化鎂、氯化鈉、碳酸鈉中的一種或幾種物質.取該樣品11.1g溶于適量水中,得到澄清的無色溶液,然后向其中加入足量的硝酸銀溶液,得到29.7g白色沉淀,則該樣品組分的下列推斷中,正確的是
A. 既無氯化鐵,也無碳酸鈉B. 只有氯化鎂,沒有氯化鈉
C. 肯定有氯化鎂,可能有氯化鈉D. 肯定有氯化鎂,也肯定有氯化鈉
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】化學與生活、科技、環境密切相關。
(1)化學與生活
①喝了汽水以后,常常會打嗝,說明氣體溶解度與_________________有關。
②炒菜時油鍋中的油不慎著火,可采取的滅火方法是_______________或放入較多蔬菜。
(2)化學與科技
交警通過吹氣法檢查司機“酒駕”的化學原理是:橙色K2Cr2O7的酸性溶液遇乙醇迅速反應生成硫酸鉻,其溶液含鉻離子(Cr3+)而為藍綠色。下列相關說法正確的是_________。
A.酒中含有的酒精屬于有機物
B.K2Cr2O7屬于氧化物
C.交警能聞到酒味是因為分子之間有空隙
D.硫酸鉻的化學式為Cr2(SO4)3
(3)化學與環境
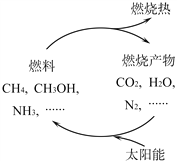
日益嚴峻的能源危機促進了可再生能源的研究。有專家提出:如果能夠利用太陽能使燃料燃燒產物,如CO2、H2O、N2等重新組合(如下圖),可以節約燃料,緩解能源危機。
①在此構想的物質循環中太陽能最終轉化為___________能。
②試根據圖示寫出氨氣作為燃料燃燒的化學方程式___________。
③___________g甲醇(CH3OH)中碳元素質量與16g甲烷中碳元素質量相等。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某化學課堂圍繞“酸堿中和反應”在老師引導下開展探究活動。以下是教學片段,請你參與學習并幫助填寫空格(包括表中空格)
[演示實驗]將一定量的稀H2SO4加入到盛有NaOH溶液的小燒杯中。
該反應的化學方程式為____________________。
[提出問題]實驗中未觀察到明顯現象,部分同學產生了疑問:反應后溶液中溶質是什么呢?
[假設猜想]針對疑問,大家紛紛提出猜想。甲組同學的猜想如下:
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:________________________。
乙組同學對以上猜想提出質疑,認為有一種猜想是不合理的,不合理的猜想是________。
[實驗探究](1)丙組同學取燒杯中的溶液少量于試管中,滴加幾滴CuSO4溶液,無明顯變化,溶液中一定沒有____________。
(2)為了驗證其余猜想,各學習小組利用燒杯中的溶液,并選用老師提供的酚酞溶液、鐵片、Na2CO3溶液,進行如下三個方案進行探究。
實驗方案 | ①加入酚酞溶液 | ②加入鐵片 | ③滴入溶液 |
實驗操作 |
|
|
|
實驗現象 | 溶液不變色 | _________ | 產生氣泡 |
實驗結論 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
[得出結論]通過探究,全班同學一致確定猜想二是正確的。
[評價反思](1)老師對同學們能用多種方法進行探究給予肯定。同時指出實驗方案①不能得出正確結論,原因是_______________。
(2)請你再選擇一種以上三種試劑屬不同類別的試劑進行驗證,寫出實驗步驟和現象_______________________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】根據圖回答:
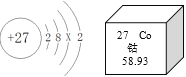
(1)鈷原子的核電荷數是_____,X=_____。
(2)鈷在化學反應中容易_____(填“得到”或“失去”)電子,相對原子質量是_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】李小龍,祖籍廣東佛山市順德區均安鎮,不僅是享譽海內外的功夫巨星也是一位武術哲學家。其創立的截拳道,體現了融合生成的方法論思想。在化學學習過程中,老師設計了如圖的“功夫小子”游戲,圖中A B C D E F G H分別是氫氣、稀鹽酸、鐵粉、氧化銅、碳酸鋇、二氧化碳、澄清石灰水、純堿溶液中的一種,游戲規則:①要求相連的兩種物質能發生化學反應,且E與F不反應,G與H不反應;②B與D的物質類別相同;③物質不能重復。請你參加完成游戲,并回答下列問題:
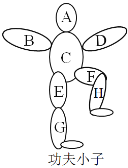
(1)找出圖中物質的化學式:A:_____;D:_____。
(2)已知B能與F反應,該反應的化學方程式為_____,該反應常用來_____。
(3)E→H的反應基本類型與E和G的反應類型相同,寫出E→H的化學方程式:_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】過氧化鎂(MgO2)是一種鎂精細化工產品。在醫療上可用來治療消化不良、胃酸過多等疾病。在環境保護方面,過氧化鎂可用來處理地下水污染的土壤。還可以用于牙膏,對牙齒有漂白和防過敏的作用。某化學興趣小組對過氧化鎂的性質和制備等進行了以下研究。
一.過氧化鎂的性質
(1)過氧化鎂(其中氧元素的化合價為____)是一種白色的粉末,其外觀與物理性質與氧化鎂相似。化學性質不夠穩定,不溶于水,但逐漸的被分解放出氧氣。
過氧化鎂有強氧化性,常溫下比較穩定,但是加熱時會分解生成氧氣和氧化鎂。請下出該反應的化學方程式________。
(2)過氧化鎂易溶于稀鹽酸,發生反應:MgO2+2HCl=MgCl2+H2O2同時溫度升高,說明該反應熱量__________(填“放出”或“吸收”)。
二.過氧化鎂的制備
下圖是利用堿式碳酸鎂(Mg2(OH)2CO3)和30%的過氧化氫溶液來制取過氧化鎂。
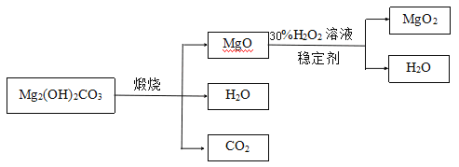
(資料)①堿式碳酸鎂與碳酸鎂有相似的化學性質,能與稀鹽酸反應產生二氧化碳②氧化鎂與過氧化氫反應放出大量的熱
(3)檢測煅燒過程堿式碳酸鎂完全分解的方法是_________(寫出具體的操作和現象);上述生產過程加入穩定的劑的作用是________。
(4)用上述堿式碳酸鎂在550、600、650及700℃下煅燒一定的時間生成氧化鎂。用上述條件制備的氧化鎂分別與30%雙氧水反應合成過氧化鎂產率(見圖1和圖2)。
堿式碳酸鎂煅燒的溫度適宜控制在________℃,煅燒的時間適宜控制在______h。
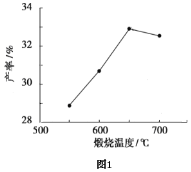
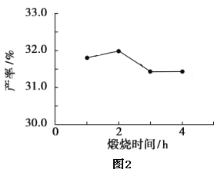
(5)結果在適宜的溫度和時間下,堿式碳酸鎂能完全分解,并且得到的氧化鎂顆粒表面積最大,能與30%過氧化氫充分反應,所以產率高。推測700℃時,產率明顯降低的可能的原因____。
三.過氧化鎂產品純度檢測
在生產過程中,過氧化鎂中常常含有少量的氧化鎂雜質(其他雜質不考慮),以下是該小組進行純度檢測的實驗裝置和實驗步驟。

①檢查裝置氣密性,裝入藥品(樣品質量為0.7g),調節刻度管使左右兩邊液面相平,刻度管度數為10.0mL。
②打開分液漏斗開關,待瓶中無氣泡產生時,關閉開關。
③再次調節刻度管使左右兩邊液面相平,刻度管度數為122mL。
(6)稀鹽酸中放入的少量硫酸銅溶液目的是__________。
(7)根據上面實驗數據計算樣品中過氧化鎂的質量分數__________(寫出具體的計算過程,實驗條件下O2密度為1.429g/L)。
(8)該小組同學所測得質量分數比實際結果偏大,你覺得可能的原因是(_______)
A 生成的氧氣有少量溶于水 B 未等裝置冷卻到室溫就開始讀數
C 雜質與鹽酸反應能產生少量的氣體 D 滴入的稀鹽酸占了一部分氣體的體積
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com