
【題目】氧化鎂在醫藥等行業應用廣泛。實驗室以菱鎂礦(主要成分為MgCO3,含少量FeCO3,其他雜質不溶于水和酸)為原料制備高純氧化鎂的實驗流程如下:
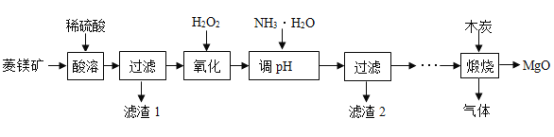
(1)為了提高“酸浸”的效果,可采取的措施有:適當升高溫度、____________。MgCO3與稀硫酸反應的化學方程式為_________________。
(2)“氧化”過程中,將FeSO4全部轉化為Fe2(SO4) 3,然后加氨水,調節溶液的PH范圍為______________。(已知部分金屬陽離子以氫氧化物形成沉淀時溶液的pH見下表)
對應離子 | Fe3+ | Fe2+ | Mg2+ |
開始沉淀時的pH | 2.7 | 7.9 | 9.4 |
完全沉淀時的pH | 3.7 | 9.6 | 11.4 |
(3)過濾后得到濾渣2和濾液,濾渣2是______(填化學式),此時濾液中的陽離子一定含有____________(填離子符號)。
(4)煅燒過程存在以下反應:![]() ;
;![]() ;
;![]()
已知:①硫在常溫下是一種淡黃色固體,硫的熔點約為115.2°C,沸點約為444.7°C;②高錳酸鉀溶液與SO2反應會褪色,且只吸收SO2,不吸收CO2;③堿溶液既吸收SO2,又吸收CO2。利用下圖裝置對煅燒產生的氣體進行檢驗并收集。
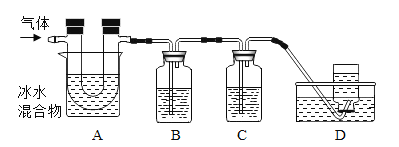
①集氣瓶B中盛放的溶液是_______________(填字母),C中盛放的溶液是_____________(填字母)。
a Ca(OH)2溶液
b KMnO4溶液
c NaOH溶液
d BaCl2溶液
②裝置D的作用是__________________________。
【答案】將礦石粉粹等 MgCO3+H2SO4=MgSO4+H2O+CO2↑ 3.7—9.4 Fe(OH)3 Mg2+、NH4+ b c 收集一氧化碳,防止污染空氣
【解析】
(1)為了提高“酸浸”的效果,可采取的措施有:適當升高溫度、將礦石粉粹等。MgCO3與稀硫酸反應生成了硫酸鎂、二氧化碳和水,化學方程式為:MgCO3+H2SO4=MgSO4+H2O+CO2↑。
(2)“氧化”過程中,將FeSO4全部轉化為Fe2(SO4)3,然后加氨水,為了將鐵離子沉淀鎂離子不沉淀,調節溶液的pH范圍為:3.7—9.4。
(3)由題意可知,碳酸鎂和硫酸反應生成硫酸鎂、水和二氧化碳,過氧化氫在酸性條件下氧化硫酸亞鐵為硫酸鐵,硫酸鐵與氨水反應生成了氫氧化鐵沉淀和硫酸銨,所以濾渣2是Fe(OH)3,此時濾液中的陽離子一定含有:Mg2+、NH4+。
(4)①由題意可知,高錳酸鉀溶液與SO2反應會褪色,且只吸收SO2,不吸收CO2; 堿溶液既吸收SO2,又吸收CO2,應先用高錳酸鉀溶液檢驗并除去二氧化硫,再用石灰水檢驗二氧化碳、用氫氧化鈉除去二氧化碳(或者足量石灰水檢驗并除去二氧化碳,題干中沒有說明足量,不能選用),最后收集一氧化碳,所以集氣瓶B中盛放的溶液是KMnO4溶液,C中盛放的溶液是NaOH溶液。
②混合氣體通過A除去了硫,通過B檢驗并除去了二氧化硫,經過C中的堿溶液除去了二氧化碳,最后收集到的氣體是一氧化碳,所以裝置D的作用是:收集一氧化碳,防止污染空氣。
故答案為:(1)將礦石粉粹等;MgCO3+H2SO4=MgSO4+H2O+CO2↑。
(2)3.7—9.4。
(3)Fe(OH)3;Mg2+、NH4+。
(4)①b;c;②收集一氧化碳,防止污染空氣。


科目:初中化學 來源: 題型:
【題目】盛有等質量、等質量分數稀鹽酸的兩只燒杯,放在托盤天平的左右兩盤,天平平衡,在左盤燒杯中加入 10gCaCO3,恰好完全反應,若要使天平重新平衡,則右盤燒杯中應加入的下列物質是( )
A.5.6g 鐵和鋅
B.10g 鎂和氧化鎂
C.10g 碳酸鎂
D.10g 碳酸鎂和碳酸鋅
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖是某同學所在化學活動實驗小組同學的實驗,他們在探究稀硫酸的某些化學性質,請回答下列問題:(如圖)
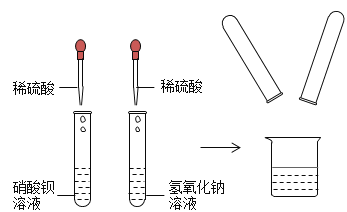
請寫出右邊試管中發生的反應方程式:_____。左邊試管中的實驗現象為_____。甲乙同學實驗后,將左邊試管過濾后的濾液和右邊試管實驗后的溶液倒入同一只燒杯中,觀察到有白色沉淀生成,由此可知左邊試管中溶質為_____,將燒杯中的沉淀濾去,得到濾液。
(提出問題)燒杯中濾液的溶質中離子除了Na和NO3-外,甲同學的猜想:OH-、SO42-
乙同學的猜想:OH-、Ba2
丙同學的猜想:H+、Ba2
還含有哪些離子?_________
(實驗驗證)丙同學為了驗證自己的猜想,取燒杯中的溶液少許于試管中,向其中加入少量的硫酸鈉溶液,觀察到產生白色沉淀的現象,于是得出結論:自己的猜想正確,甲的猜想不正確。乙同學認為丙得出的結論不正確。請對丙同學的實驗及現象做出評價_____。
乙同學進行了自己的驗證實驗,取少量燒杯中的溶液于試管中,向其中滴加硫酸銅溶液,觀察到有白色和藍色沉淀的現象,于是得出結論:其溶質中的離子成分是_____。
(反思與總結)乙、丙兩位同學的實驗所選用的試劑不同,得出結論也不相同,由兩位同學的驗證實驗總結得出:在驗證猜想的溶液中溶質離子成分時,所選試劑要求是_____就能一次性驗證溶質離子成分。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】實驗室欲測定一瓶標簽破損的稀硫酸中溶質的質量分數,現取10g稀硫酸樣品,將5%的NaOH溶液逐滴加入到樣品中,邊加邊攪拌,隨著NaOH溶液的加入,溶液pH的變化情況如圖所示。分析并計算:
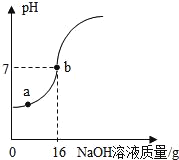
(1)a點溶液中含有的離子是_____。
(2)當pH=7時,消耗氫氧化鈉溶液中NaOH質量為_____g。
(3)計算稀H2SO4中溶質的質量分數。_____
(4)計算恰好完全反應時所得溶液的溶質質量分數。_____
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列圖像能正確反應其對應關系的是()
A.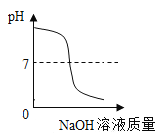 向一定體積的稀硫酸中逐滴加入足量的氫氧化鈉溶液
向一定體積的稀硫酸中逐滴加入足量的氫氧化鈉溶液
B.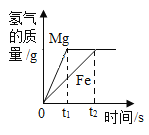 向足量的鎂和鐵中加入等質量、等質量分數的稀硫酸
向足量的鎂和鐵中加入等質量、等質量分數的稀硫酸
C.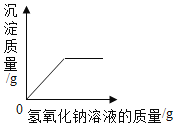 向硫酸鎂和硫酸的混合溶液中逐漸加入氫氧化鈉溶液
向硫酸鎂和硫酸的混合溶液中逐漸加入氫氧化鈉溶液
D.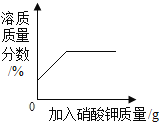 某溫度下,向一定量飽和硝酸鉀溶液中加入硝酸鉀晶體
某溫度下,向一定量飽和硝酸鉀溶液中加入硝酸鉀晶體
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列實驗設計不能達到實驗目的是( )
選項 | A | B | C | D |
實驗目的 | 干燥二氧化碳 | 證明CO2密度比空氣的大 | 測定空氣中氧氣含量 | 證明分子不斷運動 |
實驗方案 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】小明同學已經知道鎂能與氧氣反應,還想用金屬鎂設計實驗驗證金屬的其它化學性質。
預測 | 預測的依據 | 驗證預測的實驗操作與預期現象 |
①能夠與酸反應 | 鋅能與稀硫酸反應產生氫氣,鎂比鋅活潑。 | _____,則預測成立 |
②能夠與鹽反應 | _____ | 往裝有2mLCuSO4溶液的試管中放入一根用砂紙打磨干凈的鎂條,觀察到鎂條表面有氣泡,一段時間后,藍色溶液變淡,試管底部有紅色固體。 |
小明發現,鎂條放入CuSO4溶液中,鎂條表面有氣泡產生,為什么呢?小明想,鎂是不是能跟水發生反應呢?
于是,他將鎂條放到盛有冷水(蒸餾水)的試管中,沒有明顯的現象,然后將試管放在酒精燈上加熱,發現試管中有氣泡產生。
(提出問題)加熱時鎂條與水發生反應嗎?生成的物質是什么呢?
(猜想與假設)
(1)甲同學認為,加熱時應該先將蒸餾水煮沸并迅速冷卻,理由是_____。
(2)甲同學認為,加熱時鎂和水反應生成的氣體是_____(選填a、H2或b、N2),不選擇另一項的理由是_____。
(實驗驗證)乙同學向加熱的試管中滴入酚酞溶液,溶液顯紅色。
(實驗結論)
(3)鎂在加熱時與水發生反應,因為加熱后溶液中生成了_____性物質。請根據分析寫出二者反應的化學方程式_____,看來,關于鎂與硫酸銅溶液的反應還是比較復雜的,小明決定接下來跟老師一起繼續探究。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖是甲、乙兩物質的溶解度曲線圖,下列說法不正確的是( )
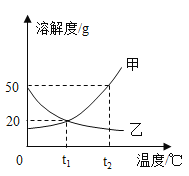
A.t2℃時,甲物質的溶解度大于乙物質的溶解度
B.將t2℃時甲物質的飽和溶液降溫到t1℃,溶液仍然飽和
C.t1℃時,將l5g乙物質加入到50g水中,充分攪拌,能得到乙的飽和溶液
D.將t2℃時甲、乙兩種物質的飽和溶液降溫至t1℃,所得溶液中溶質質量分數大小為甲=乙
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】根據下列實驗裝置圖,按要求回答下列問題:

(1)寫出儀器a的名稱:_______________。
(2)實驗室可用高錳酸鉀制取氧氣,其反應的化學方程式為①_______________,基本反應類型為②_______________; 選用的發生裝置是③_______________,收集裝置是④_______________。
(3)實驗室制取并收集二氧化碳應選擇的裝置為①_______________。驗滿二氧化碳的方法是②_______________。
(4)小明同學用F裝置驗證二氧化碳的性質,當通入一段時間后,試管①中產生的現象是_______________,試管②中澄清石灰水變渾濁,反應的化學方程式為_______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com