
【題目】錳是治煉工業中常用的添加劑。以碳酸錳礦(主要成分為MnCO3,還含有 FeCO3、NiCO3等雜質)為原料生產金屬錳的工藝流程如下圖,請回答以下問題:
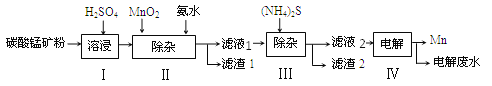
(1)步驟Ⅰ中,將碳酸錳礦研磨成粉末的主要目的是_______,其中碳酸錳與硫酸反應的化學方程式為_________________。
(2)步驟Ⅱ中,先加入二氧化錳發生以下反應:MnO2+2FeSO4+2H2SO4=MnSO4+2H2O+x,x的化學式為______;已知濾液1中的主要溶質為MnSO4同時還含有少量NiSO4,則步驟Ⅱ中加入氨水的主要目的是________。
(3)步驟Ⅲ中,所得濾液2中含有的溶質為MnSO4、(NH4)2SO4,則濾渣2中主要成分為______(填化學式)
(4)步驟Ⅳ中,電解后的廢液中還含有Mn2+,常用石灰乳進行一級沉降得到沉淀Mn(OH)2和氨氣,過濾后,再向濾液中加入Na2S進行二級沉降得到沉淀MnS。寫出二級沉降過程中發生的化學反應方程式:___________________;沉降過程的產物中,______________________可循環利用于上述流程。
【答案】 增加反應物之間的接觸面積,使反應更充分,同時加快反應速率 MnCO3 + H2SO4 = MnSO4 + H2O + CO2 ↑ Fe2(SO4)3 除去鐵離子 NiS MnSO4+ Na2S = Na2SO4 + MnS↓ 氨氣
【解析】(1)根據將碳酸錳礦研磨成粉末的主要目的是增加反應物之間的接觸面積,使反應更充分,同時加快反應速率解答;根據碳酸錳與硫酸反應生成硫酸錳、水、二氧化碳解答;(2)根據質量守恒定律分析解答;根據濾液1中不含鐵離子解答;(3)根據濾液1中的主要溶質為MnSO4同時還含有少量NiSO4,NiSO4與加入的(NH4)2S反應分析解答;(4)根據MnSO4與Na2S反應,生成Na2SO4 和 MnS解答;根據題中信息可知,有氨氣生成,氨氣可通入步驟Ⅱ循環利用解答。(1)步驟Ⅰ中,將碳酸錳礦研磨成粉末的主要目的是增加反應物之間的接觸面積,使反應更充分,同時加快反應速率;碳酸錳與硫酸反應生成硫酸錳、水、二氧化碳,反應的化學方程式為MnCO3+H2SO4=MnSO4+H2O+CO2 ↑;(2)反應前Mn、O、Fe、SO42-、H個數為1、2、2、4、4,反應后Mn、O、Fe、SO42-、H個數為1、2、0、1、4,反應前后Fe相差2個,SO42-相差3個,又x前的化學計量數為1,故x的化學式為Fe2(SO4)3;又濾液1中的主要溶質為MnSO4同時還含有少量NiSO4,不含Fe2(SO4)3,則步驟Ⅱ中加入氨水的主要目的是除去鐵離子;(3) 濾液1中的主要溶質為MnSO4同時還含有少量NiSO4,又步驟Ⅲ中,所得濾液2中含有的溶質為MnSO4、(NH4)2SO4,故NiSO4與加入的(NH4)2S反應,反應的化學方程式為NiSO4+(NH4)2S=(NH4)2SO4+ NiS↓,故濾渣2中主要成分為NiS;(4)MnSO4與Na2S反應,生成Na2SO4 和 MnS,反應的化學方程式為MnSO4+Na2S=Na2SO4 + MnS↓;由題中信息可知,有氨氣生成,故氨氣可循環利用于上述流程。


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:
【題目】2014年以來,西非的一些國家暴發埃博拉病毒,致使幾千人喪命。中藥葛根是治療埃博拉病毒的有效成分之一,葛根的主要成分是葛根素,它的化學式是C21H20O9,下列有關葛根素的說法正確的是( )
A. 葛根素由21個碳原子、20個氫原子和9個氧原子構成的
B. 葛根素中碳、氫、氧元素質量比是21︰20︰9
C. 葛根素的相對分子質量是416
D. 葛根素中氧元素的質量分數最大
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】氯化亞銅(CuCl)廣泛應用于冶金、電鍍、醫藥等行業。已知CuCl難溶于水和乙醇,在潮濕空氣中易變質。CuCl的制備流程如下:
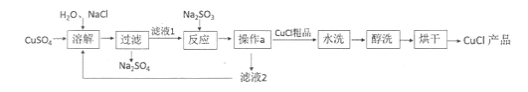
(1)“濾液1”中除了Na+、SO42-外,還存在較多的離子是 、 (寫離子符號)
(2)“反應”中發生的化學變化是2CuCl2+Na2SO3=2CuCl↓+2NaCl+SO3,產生的SO3迅速與水化合生成一種酸,該反應的化學方程式為 。
(3)“操作a”的名稱是 。本流程中可以循環利用的物質(水除外)是 。(寫化學式)
(4)可用“水洗”的原因是 ,“醇洗”的目的是 。
(5)160g CuSO4與足量NaCl經上述制備流程,可生成的CuCl最多是 g。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(6分)某補鈣劑說明書的部分信息如下圖所示。現將有20片該藥劑制成的粉末與40g鹽酸混合(其他成分不與鹽酸反應),恰好完全反應后稱得剩余物的質量為55.6g。

(1)青少年缺鈣出現的疾病是 。
(2)該品牌補鈣劑每片含的CaCO3質量為多少?
(3)該鹽酸中溶質的質量分數是多少?(精確到0.1%)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(4分)我們學習化學的目的之一就是學會從化學的視角認識和分析生活生產中的一些問題。
(1)2013 年濟南市整合趵突泉、大明湖、五龍潭、護城河等旅游資源,組建天下第一泉風景區,它集獨特的自然山水景觀和深厚的歷史文化底蘊于一體,為 5A 級景區。

①對泉水的下列說法中明顯錯誤的是 (填序號)
A.清澈的泉水是溶液 B.蒸餾是凈化程度很高的凈水方法
C.可用煮沸的方法降低泉水的硬度 D.過濾可以除去泉水中的可溶性雜質
②某化學小組的小泉同學取2滴非常清澈的趵突泉水滴在潔凈的玻璃片上,置于酒精燈上小心加熱,水分消失后,觀察到玻璃片上有少許固體殘留物,產生該現象的原因是
。
③濟南市區居民的大部分飲用水來自地表天然水,天然水轉化成飲用水需經一系列凈化,Cl2是一種廉價的自來水消毒劑,與水反應生成次氯酸(HClO)有較強的殺菌作用。氯氣(Cl2)和次氯酸中氯元素的化合價分別是 。
(2)化學與食品安全、環境保護、人體健康等密切相關。下列說法錯誤的是 (填序號)
A.在食鹽中添加適量碘酸鉀,補充人體所需的碘元素
B.“低碳生活”倡導大量使用化石燃料,鼓勵人們多開汽車出行
C.香煙的煙氣中含有許多有毒物質,吸煙有害健康
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖是A、B、C三種物質的溶解度曲線。下列說法不正確的是
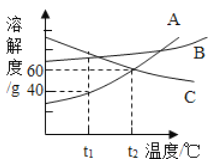
A. t1℃時,A的溶解度小于C的溶解度
B. t1℃時,100g水溶解了40gA就達到了飽和狀態
C. t2℃時,A和C的飽和溶液中溶質的質量相等
D. A和B的飽和溶液從t2℃降到t1℃時,溶液的溶質質量分數都變小
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】氯化鈣在生活中常用作干燥劑、融雪劑,在工業上可用于制造防凍液等。某工廠以石灰石為原料生產氯化鈣晶體的流程如下。原料石灰石中含有雜質主要是MgCO3、MgSO4 和Al2O3。
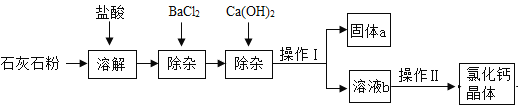
⑴石灰石粉溶解時,Al2O3發生反應的化學方程式為________________。
⑵加入BaCl2除去的雜質離子是____________(填離子符號);
⑶操作Ⅰ的名稱為____________,需用到的實驗儀器有:鐵架臺(帶鐵圈)、漏斗、燒杯、____________。操作Ⅱ的具體步驟為:____________、冷卻結晶。
⑷固體a的成分一定含有________________________(只寫一種)。檢驗溶液b的酸堿性,如果顯堿性,還需加入適量的____________ (填化學式)提高產品純度。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】微觀示意圖可以形象的表示物質發生的微觀變化
(1)請在下圖第一、三方框中把硫化氫在氧氣中燃燒(2H2S+3O2![]() 2SO2+2H2O)的微觀示意圖補畫完整。______________
2SO2+2H2O)的微觀示意圖補畫完整。______________
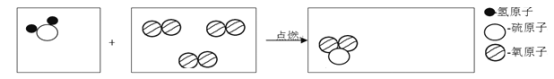
(2)在上述化學反應中,化合價不發生改變的元素是_________(填符號)
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】我國化學家侯德榜(如圖)改革國外的純堿生產工藝,生產流程可簡要表示如下:


(1)上述生產純堿的方法稱____________________,副產品的一種用途為_________________。
(2)向沉淀池中通入兩種氣體,先通入的是________________(填“NH3”或“CO2”),沉淀池發生的化學反應方程式是_______________________________。
(3)寫出上述流程中X物質的化學式_____________________。
(4)使原料氯化鈉的利用率從70%提高到90%以上,主要是設計了_____________(填“循環I”或“循環II”)。從沉淀池中取出NaHCO3沉淀的操作是__________________。
(5)為檢驗產品碳酸鈉中是否含有氯化鈉,可取少量試樣溶于水后,先滴加足量的_______,排除Na2CO3的干擾,再滴加___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com