
【題目】科學方法對化學學習起著事半功倍的作用。
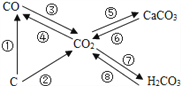
(1)分類歸納是研究化學物質的重要方法。如圖是某同學整理的碳及其化合物的知識網絡圖,轉化③常用于冶煉工業,工業上用赤鐵礦煉鐵時,反應的化學方程式為_____________,二氧化碳使紫色石蕊試液變紅涉及的反應是如圖所示轉化中_______(填序號)。
(2)微觀粒子模型化是研究化學變化的重要方法。
①下圖是鈉與氯氣反應生成氯化鈉的示意圖。該圖說明在化學反應過程中一定發生變化的是__________(填字母)。
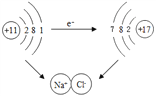
A.原子核 B.原子核最外層電子數 C.原子的電子層數
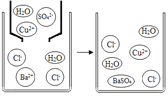
②下圖是硫酸銅溶液與氯化鋇溶液反應示意圖。從粒子角度分析該化學反應能發生的原因是___________________________。
③A、B、C、D表示4種物質,下圖是部分物質的微觀示意圖。A和B在一定條件下反應生成C和D。
物質 | B | C | D |
|
微觀示意圖 |
|
|
|
若一定質量的A和4.8g B恰好完全反應,可生成4.4gC和2.7gD,則A的化學式是____。
④我國科學家創造性地構建了“單中心鐵催化劑”,在甲烷高效轉化研究中獲得重大突破。甲烷轉化反應的微觀示意圖如下:
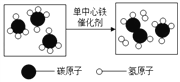
圖示所表示的反應的化學方程式為___________________。
(3)控制變量、設計對比實驗是實驗探究的重要方法。
下圖實驗是大小形狀相同的Mg、Zn、Fe、Cu四種金屬同時投入到鹽酸中發生的現象,金屬周圍的黑點表示生成的氣體。下列結論不正確的是__(填字母)。
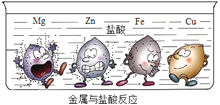
A.銅不能發生置換反應
B.四種金屬中金屬活動性最強的是Mg
C.等質量的鋅和鐵分別與足量的鹽酸反應生成氣體質量:Zn比Fe多
【答案】 Fe2O3+3CO![]() 2Fe+3CO2 ⑦ B 鋇離子和硫酸根離子結合生成難溶于水的硫酸鋇沉淀 C2H6O(或C2H5OH) 2CH4
2Fe+3CO2 ⑦ B 鋇離子和硫酸根離子結合生成難溶于水的硫酸鋇沉淀 C2H6O(或C2H5OH) 2CH4 ![]() C2H4+2H2 AC
C2H4+2H2 AC
【解析】(1)根據氧化鐵與一氧化碳在高溫的條件下反應生成鐵和二氧化碳解答;根據二氧化碳與水反應生成碳酸,碳酸顯酸性使紫色石蕊溶液變紅解答;(2)①根據物質的化學性質與原子的最外層電子數有關進行分析;②根據硫酸銅和氯化鋇反應生成硫酸鋇沉淀和氯化銅進行分析;③根據反應的微觀示意圖結合相關數據計算解答;④根據反應的微觀示意圖分析解答;(3)根據在金屬活動性順序中,只有排在氫前的金屬才可以和稀酸溶液反應生成氫氣,而且越靠前的金屬活動性就越強,和稀酸溶液反應時現象就越劇烈進行分析。(1)氧化鐵與一氧化碳在高溫的條件下反應生成鐵和二氧化碳,反應的化學方程式為Fe2O3+3CO高溫2Fe+3CO2;二氧化碳與水反應生成碳酸,碳酸顯酸性使紫色石蕊溶液變紅,故選⑦;(2)①圖甲是鈉與氯氣反應生成氯化鈉的示意圖,該圖說明在化學反應過程中,原子核不變,電子層數可能變化,原子在發生化學變化時,通過得失電子形成化合物,所以一定發生變化的是B;②硫酸銅和氯化鋇反應生成硫酸鋇沉淀和氯化銅,所以從粒子角度分析該化學反應能發生的原因是:鋇離子和硫酸根離子結合生成難溶于水硫酸鋇沉淀;③由圖可知,B、C、D分別為氧氣、二氧化碳、水。二氧化碳中氧元素的質量=4.4g×![]() =3.2g,二氧化碳中碳元素的質量=4.4g-3.2g=1.2g;水中氧元素的質量=2.7g×
=3.2g,二氧化碳中碳元素的質量=4.4g-3.2g=1.2g;水中氧元素的質量=2.7g×![]() =2.4g,水中氫元素的質量=2.7g-2.4g=0.3g;故A中碳元素的質量為1.2g,氧元素的質量=3.2g+2.4g-4.8g=0.8g,氫元素的質量為0.3g。A中C、H、O的原子個數比為
=2.4g,水中氫元素的質量=2.7g-2.4g=0.3g;故A中碳元素的質量為1.2g,氧元素的質量=3.2g+2.4g-4.8g=0.8g,氫元素的質量為0.3g。A中C、H、O的原子個數比為![]() =2:6:1,那么A的化學式為C2H6O(或C2H5OH);④由圖可知,該反應的化學方程式為2CH4
=2:6:1,那么A的化學式為C2H6O(或C2H5OH);④由圖可知,該反應的化學方程式為2CH4 ![]() C2H4+2H2;(3)在金屬活動性順序中,只有排在氫前的金屬才可以和稀酸溶液反應生成氫氣,而且越靠前的金屬活動性就越強,和稀酸溶液反應時現象就越劇烈,所以A、銅不能與酸發生反應,銅可以將硝酸銀中的銀置換出來,所以不能說銅不會發生置換反應,錯誤;B、鎂表面的氣泡產生最劇烈,所以四種金屬中金屬活動性最強的是Mg,正確;C、每65份質量的鋅會生成2份質量的氫氣,每56份質量的鐵會生成2份質量的氫氣,所以等質量的鋅和鐵分別與足量的鹽酸反應生成氣體質量:Zn比Fe少,錯誤。故選AC。
C2H4+2H2;(3)在金屬活動性順序中,只有排在氫前的金屬才可以和稀酸溶液反應生成氫氣,而且越靠前的金屬活動性就越強,和稀酸溶液反應時現象就越劇烈,所以A、銅不能與酸發生反應,銅可以將硝酸銀中的銀置換出來,所以不能說銅不會發生置換反應,錯誤;B、鎂表面的氣泡產生最劇烈,所以四種金屬中金屬活動性最強的是Mg,正確;C、每65份質量的鋅會生成2份質量的氫氣,每56份質量的鐵會生成2份質量的氫氣,所以等質量的鋅和鐵分別與足量的鹽酸反應生成氣體質量:Zn比Fe少,錯誤。故選AC。


科目:初中化學 來源: 題型:
【題目】實驗操作技能越來越受重視,下列實驗操作不正確的是
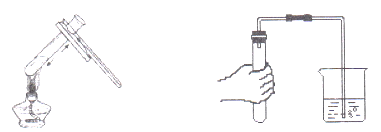
A. 加熱液體 B. 檢查裝置氣密性
C. 濃硫酸濺到皮膚上,立即用大量水沖洗,再涂上3%~5%的小蘇打溶液 D. 配制50克5%的NaCl溶液時,把稱好的固體倒入到量好水的量筒中進行溶解
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】同學們可以通過下列方式認識空氣。
①空氣中體積分數約為78%的物質是_____。
②為測定空氣中氧氣的體積分數,設計如圖實驗。
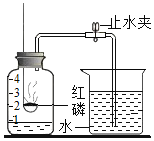
Ⅰ.為了確保實驗成功,在裝藥品之前應該檢查裝置的__________。
Ⅱ.該實驗中紅磷需要過量的原因是___________。
Ⅲ.紅磷燃燒的現象是_____,反應的化學方程式_____________。
Ⅳ.冷卻至室溫后打開止水夾觀察到的現象是____________。由此得出空氣中氧氣的體積分數約為_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】將一小塊銀白色的金屬鈉放置在空氣中會發生下列變化:
![]()
[查閱資料]
I.鈉的氧化物有氧化鈉(Na2O)和過氧化鈉(Na2O2),都能與水反應,反應化學方程式如下:Na2O + H2O = 2NaOH 2Na2O2 + 2H2O = 4NaOH + O2↑
II. CaCl2溶液呈中性;碳酸鈉溶液能與CaCl2溶液或Ca(OH)2溶液發生復分解反應;
碳酸鈉溶液與鹽酸反應方程式有:Na2CO3 +HCl=NaHCO3 +NaCl、Na2CO3+2HCl=2NaCl+H2O+CO2↑
(1)為檢驗常溫下鈉與氧氣反應的產物,是Na2O還是Na2O2,完成實驗方案:
選取試劑 | 實驗現象 | 實驗結論 |
__________________ | __________________________ | 產物為Na2O |
⑵ 鈉在空氣中放置一段時間得到白色固體的成分
猜想1:Na2CO3 猜想2:NaOH 猜想3:Na2CO3和NaOH
[實驗過程]
[實驗1] 取少量白色固體加水配成溶液,再滴入幾滴稀鹽酸,無氣泡產生。
化學小組認為:據此現象,還不能得出猜想2成立。理由是________________。
[實驗2] 化學小組進行如下實驗
實驗操作 | 實驗現象 | 實驗結論 |
①取少量白色固體配成溶液,加入足量_______; | _______ | 猜想3成立 |
②過濾,取少量濾液滴入________________。 | _________ |
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】常用儀器的使用、常見氣體的制取是初中化學實驗的基礎內容,請根據下列實驗裝置回答問題。
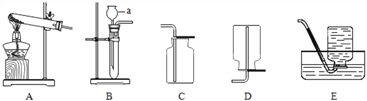
(1)寫出儀器名稱:a_________________。
(2)實驗室用A裝置制取氧氣的化學方程式:____________________________。
(3)實驗室收集二氧化碳的裝置是__________,用化學方程式表示檢驗二氧化碳的原理__________________。
(4)二氧化氯(ClO2)可用作消毒劑。常溫下,ClO2是一種橙黃色、有刺激性氣味的氣體,11℃以下為紅色液體,易溶于水,見光易分解,可用固體氯酸鈉(NaClO3)與濃鹽酸反應制取,反應的化學方程式為:2NaClO3 + 4HCl═2ClO2↑+ Cl2↑+ 2X + 2NaCl。
①制取氣體的發生裝置是____________(填裝置序號)。
②上述反應中X的化學式為_________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】氯化亞鐵具有獨特的脫色能力,廣泛用于印染、造紙等行業。
已知:①氯化鐵易與水反應;②在加熱條件下,氫氣能與氯化鐵反應生成FeCl2和HCl。③堿石灰中含有CaO與NaOH
某課題小組設計如下方案制備氯化亞鐵(裝置不能重復使用)。
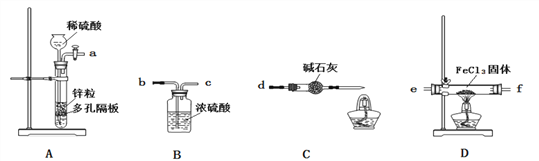
回答下列問題:
(1)實驗開始前應先檢驗裝置的氣密性。請敘述檢驗裝置A氣密性的方法:關閉活塞,____________。
(2)氣流從左至右,裝置接口連接順序是: a→ (_____)→(_____)→(______)→(________)→d
(3)裝置D中發生反應的化學方程式是____________ 。
(4)裝置C中堿石灰的作用有兩個:a、防止空氣中的水蒸氣進入;b、_______。
(5)實驗過程中,在點燃裝置D中的酒精燈之前,從安全角度考慮必須要進行的操作是______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】用“氨堿法”制得的純堿中通常含有一些氯化鈉。下列是某化學興趣小組的同學設計的測定碳酸鈉質量分數的實驗,請你幫他們完成下列問題:
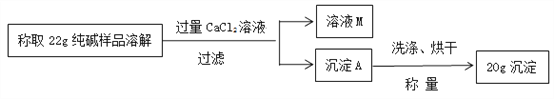
(1)溶液M中的溶質是__________(填化學式);
(2)滴加氯化鈣應“過量”,否則會使測定的結果________(填“偏大”或“偏小”);
(3)該純堿樣品中碳酸鈉的質量分數為_____________?(寫出解題過程,計算結果精確到0.1%)
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(1)根據硝酸銨的化學式進行計算
①硝酸銨的化學式量___________
②硝酸銨中氮元素、氫元素、氧元素的質量比__________
③硝酸銨中氧元素的質量分數__________
(2)將80g溶質的質量分數為20%硝酸鉀稀釋成5%,需加水多少_______g?
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】以鈦鐵礦(主要成分為 FeTiO3,同時含有少量的 Fe2O3、FeO等)為原料制 TiO2,再由 TiO2制金屬 Ti 的工藝流程如下:

【查閱資料】鈦、鎂在高溫下與空氣中的氧氣、二氧化碳等反應。
下列說法錯誤的是
A. 生成硫酸鐵的反應屬于是置換反應
B. 操作2的名稱是過濾,水解屬于化學變化
C. 用金屬鎂和 TiCl4反應的方法制備Ti,氬氣的作用是催化作用
D. TiO2可與焦炭、氯氣在高溫下反應,該反應中氯氣和碳的質量按71:12的比例參加反應,反應的化學方程式為TiO2+2Cl2+2C 高溫TiCl4+2CO
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com