
【題目】根據下列儀器裝置,回答有關問題。
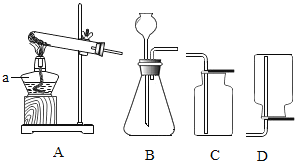
(1)制取氧氣。實驗室選用裝置A制取氧氣時,用到的化學藥品是__________ (用化學式表示);實驗結束熄滅酒精燈的操作為__________。
(2)制取二氧化碳。用一定濃度的鹽酸與石灰石反應制取二氧化碳氣體,發生反應的化學方程式為_______________。為制得干燥、純凈的二氧化碳氣體,所選裝置的連接順序為_____→ H → _____ →干燥、純凈CO2 (在橫線內填裝置序號)。
(3)進一步探究二氧化碳與氫氧化鈉溶液的反應。
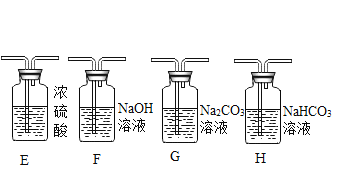
(提出問題)制取干燥、純凈的二氧化碳氣體流程中,選用裝置H而不用G,因為碳酸鈉溶液中通入二氧化碳發生反應:Na2CO3 + CO2 + H2O = 2NaHCO3。向氫氧化鈉溶液中通入一定量二氧化碳后,所得溶液中溶質是什么?
(查閱資料)碳酸氫鈉與氫氧化鈉發生反應:NaOH+NaHCO3 =Na2CO3 + H2O;Ca(HCO3)2溶于水。
(猜想)所得溶液中的溶質是:I.Na2CO3;II.NaHCO3;III.Na2CO3和NaHCO3;IV._____。
(實驗)請你參與下列驗證猜想③的實驗,完成探究報告。
步驟和方法 | 現象 | 分析 |
取少量反應后的溶液,加入足量的CaCl2溶液 | __________ | 發生反應的方程式:_____ |
__________ | 產生白色沉淀 | 結論:猜想III正確 |
(討論)二氧化碳通入一定量的氫氧化鈉溶液,影響反應后生成物成分的決定因素是________。
【答案】KClO3、MnO2 用燈帽蓋滅 CaCO3 + 2HCl = CaCl2+ H2O + CO2↑ B E NaOH和Na2CO3 產生白色沉淀 CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl 過濾,向濾液中加入少量NaOH溶液 通入CO2的量多少
【解析】
(1)裝置A是固體加熱型的發生裝置,因為試管口沒有棉花團,所以不能是高錳酸鉀制氧氣,只能是氯酸鉀和二氧化錳。實驗結束熄滅酒精燈的操作為用燈帽蓋滅。故填:KClO3和MnO2;用燈帽蓋滅。
(2)鹽酸與石灰石反應制取二氧化碳氣體,發生反應的化學方程式為:
![]() ;制得的二氧化碳氣體中可能混有氯化氫氣體(來自鹽酸)需要飽和碳酸氫鈉溶液(B裝置)除去,氯化氫能和碳酸氫鈉反應生成二氧化碳,出來的二氧化碳還會含有水蒸氣,需要濃硫酸(E裝置)干燥,所以為制得干燥、純凈的二氧化碳氣體,所選裝置的連接順序為B→ H → E →C(干燥、純凈CO2)。故填:
;制得的二氧化碳氣體中可能混有氯化氫氣體(來自鹽酸)需要飽和碳酸氫鈉溶液(B裝置)除去,氯化氫能和碳酸氫鈉反應生成二氧化碳,出來的二氧化碳還會含有水蒸氣,需要濃硫酸(E裝置)干燥,所以為制得干燥、純凈的二氧化碳氣體,所選裝置的連接順序為B→ H → E →C(干燥、純凈CO2)。故填:![]() ;B;E。
;B;E。
(3)猜想:向氫氧化鈉溶液中通入一定量二氧化碳,首先會發生![]() 反應,當二氧化碳的量不足時,溶液中的溶質就會有碳酸鈉和未反應的氫氧化鈉,故猜想IV為NaOH和Na2CO3;
反應,當二氧化碳的量不足時,溶液中的溶質就會有碳酸鈉和未反應的氫氧化鈉,故猜想IV為NaOH和Na2CO3;
實驗:步驟和方法:要驗證猜想III.Na2CO3和NaHCO3正確,取少量反應后的溶液,加入足量的CaCl2溶液,發生反應:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl ,所以現象是產生白色沉淀碳酸鈣,如果有碳酸氫鈉,它不與氯化鈣反應,因為碳酸氫鈣溶于水,不符合復分解反應特點。接著進行過濾,除去碳酸鈣沉淀,檢驗溶液中含有碳酸氫鈉,因為氯化鈣加入是足量的,所以再向濾液中加入少量氫氧化鈉,發生反應:NaOH+NaHCO3 =Na2CO3 + H2O,有碳酸鈉產生,遇到過量的氯化鈣會產生白色沉淀。從而得出猜想III.Na2CO3和NaHCO3正確。故填:產生白色沉淀;CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl;過濾,再向濾液中加入少量氫氧化鈉。
討論:二氧化碳通入一定量的氫氧化鈉溶液,二氧化碳的量不同時,生成物溶液中的溶質也不同。
當二氧化碳量較少時,氫氧化鈉沒有反應完,溶液中的成分為:氫氧化鈉和碳酸鈉,對應猜想IV;
當二氧化碳與氫氧化鈉恰好完全反應時,溶液成分只有產物碳酸鈉,對應猜想I;
當二氧化碳過量時,生成的碳酸鈉會繼續與二氧化碳反應,Na2CO3 + CO2 + H2O = 2NaHCO3,若過量的二氧化碳不能把全部碳酸鈉反應時,溶液中成分為:碳酸鈉和碳酸氫鈉,對應猜想III;
當二氧化碳的量非常多時,不僅能把氫氧化鈉完全反應,還能把生成的碳酸鈉也全部反應掉變成碳酸氫鈉,此時溶液成分只有碳酸氫鈉,對應猜想II。
所以影響反應后生成物成分的決定因素是:二氧化碳的量。故填:二氧化碳的量。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源: 題型:
【題目】下圖中的①、②分別是鎂元素、氯元素在元素周期表中的信息,A、 B、C是三種粒子的結構示意圖。試回答下列問題:
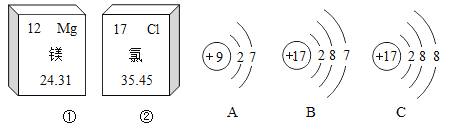
(1)鎂元素的原子序數是____________,氯元素的相對原子質量是___________________。
(2)A、B、C中化學性質相似的粒子是_____(填序號)。
(3)鎂元素和氯元素形成的化合物的化學式是________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】閱讀下面科普短文
碳元素是最早被人類認識和利用的元素。碳元素在地球上雖然廣泛分布,但其含量不足0.03%。碳元素是一切有機體骨架的組成元素,在人體中的含量約占 18%。主要以有機含碳化合物形式存在,如糖類、蛋白質等。人體中的無機含碳化合物種類較少,在血漿中主要以碳酸氫鹽緩沖系統 (H2CO3/HCO3-)的形式存在。迄今為止,發現了 15 種碳原子,它們在元素周期表中占據如圖 1 所示的同一個“格”,其中 C-12 和C-13 屬于穩定型,考古研究中,通過測定 C-14 含量估算古物的年代。20 世紀起,人類對碳元素的認識突飛猛進。下表列出了與之相關的主要事件:碳的這些新型結構的發現和性能研究的發展,使其廣泛應用于工業、材料、生物醫學等領域。依據文章內容回答下列問題:

時間 | 40 年代 | 1967 年 | 1969 年 | 1985 年 | 1991 年 | 21 世紀 |
事件 | 發現C-14 | 發現六角金剛 石和單斜超硬 碳 | 發現銀白色的白炭 | 發現富勒烯 的第一個成 員 C60(圖 2) | 發現碳納米管(圖 3) | 從石墨中剝離出僅 由一層碳原子構成 的薄片-石墨烯(圖4) |
(1)碳在人體中的存在形式有_______ 種;
(2)關于圖 1 所示的相關信息分析,錯誤的是________;
A 原子序數為 6 B 電子數為 12 C 元素符號為 C
(3)結合你所學的知識,你認為原子 C-12 和 C-13 的不同點是________;
A 質子數不同 B 電子數不同 C 中子數不同
(4)從石墨中剝離出來的石墨烯具有優良的各種性能,被認為是一種未來革命性的材料。石墨和金剛石的物理性質不同的原因是________;
(5)富勒烯 C60 中數字“60”的含義是________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】A~G是初中化學常見的物質,已知A、D、F均為單質,其中D是日常生產生活中使用最多的金屬,B是一種氧化物,C是一種常見的酸,E (相對分子質量為160)的水溶液呈藍色,它們相互轉化關系如圖所示(部分生成物和反應條件已略去)。試回答下列問題:
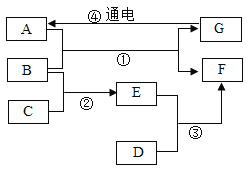
(1) B的化學式:_________________。
(2) A在生產生活中的一種用途_________________。
(3)寫出②的化學方程式_________________。
(4)反應③的化學方程式_________________;圖中所涉及到的反應中,與③屬于同種基本反應類型的是___________;(填序號)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】根據下列實驗方案進行實驗,能達到相應實驗目的是( )
A.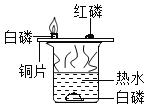 探究燃燒條件之一需要可燃物
探究燃燒條件之一需要可燃物
B.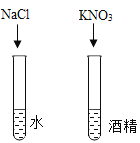 探究影響物質溶解性的因素
探究影響物質溶解性的因素
C.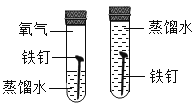 探究鐵釘生銹需要氧氣
探究鐵釘生銹需要氧氣
D. 比較Zn和Fe的金屬活動性強弱
比較Zn和Fe的金屬活動性強弱
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列圖象能正確反映其對應關系的是( )
A.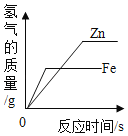 等質量的鋅粉和鐵粉分別與等質量分數的足量稀鹽酸反應
等質量的鋅粉和鐵粉分別與等質量分數的足量稀鹽酸反應
B.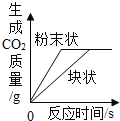 等質量,不同顆粒大小的碳酸鈣分別與等質量分數的足量稀鹽酸反應
等質量,不同顆粒大小的碳酸鈣分別與等質量分數的足量稀鹽酸反應
C.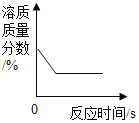 常溫下,燒杯中的 KNO3的飽和溶液中,恒溫蒸發一定質量的水
常溫下,燒杯中的 KNO3的飽和溶液中,恒溫蒸發一定質量的水
D.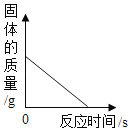 CO 還原一定質量的氧化鐵,固體質量隨反應時間的變化關系
CO 還原一定質量的氧化鐵,固體質量隨反應時間的變化關系
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】實驗室有一瓶失去標簽的過氧化氫溶液,為測定其溶質質量分數,興趣小組同學取l00g該溶液與1g二氧化錳混合,使其充分反應,產生氣體的質量和反應時間關系如圖。
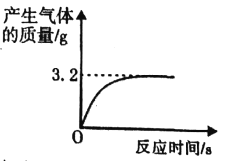
(1)完全反應后,經過濾、烘干,得到固體的質量為_______(不計操作過程中的損耗)
(2)產生氣體的速度越來越慢的原因是_______。
A.二氧化錳越來越少
B.過氧化氫溶液的溶質質盤分數越來越小
D.溫度越來越高
(3)計算所用過氧化氫溶液的溶質質量分數。(規范寫出計算過程)
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在一燒杯中盛有 200gBaCl2和 HCl 的混合溶液,向其中逐滴滴入溶質質量分數為10%的Na2CO3溶液,燒杯中溶液的質量與所滴入Na2CO3溶液的質量關系曲線如圖1所示,請根據題意回答問題:

(1)實驗過程中放出氣體的質量為 g。
(2)原混合溶液中 BaCl2的質量分數為多少?(寫出計算過程)
(3)根據計算所得數據在圖 2 中畫出產生沉淀的曲線。
(4)當入Na2CO3溶液至圖中B 點時,所得溶液中溶質的質量分數是 (結果精確到1%,即%號前取整數)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com