
【題目】以下是研究實驗室制取氣體的裝置圖,請按要求回答下列問題。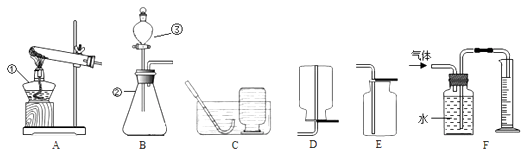
(1)寫出圖中標號儀器的名稱:①;②;③;
(2)實驗室用高錳酸鉀制取氧氣,應選用的發生裝置是 , (填字母序號,下同),該反應文字或者符號表達式為 , 該還需做的一點改動是 , 若要收集一瓶純凈的氧氣,應選擇的收集裝置是;
(3)實驗室用H2O2溶液和MnO2混合制氧氣,其中MnO2起作用,該反應的文字或者符號表達式為。同學們利用B和F裝置,來測定生成氧氣的體積,反應結束后,發現實驗結果比理論值(填“偏大”、“偏小”或者“不變”),其主要原因是;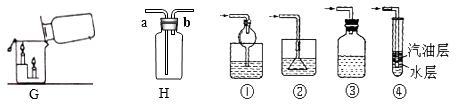
(4)實驗室制取CO2發生裝置可選用(填字母序號,下同),收集CO2通常選用裝置_ , 判斷CO2已收集滿的方法是。檢驗CO2的文字或者符號表達式為。如G圖所示,現沿燒杯壁向燒杯內傾倒二氧化碳,觀察到的現象為;
(5)通常情況下,氨氣是一種無色、有刺激性氣味的氣體,密度比空氣小,極易溶于水,形成的溶液是氨水。實驗室用加熱氯化銨和氫氧化鈣的固體混合物制取氨氣。應選用的發生裝置是(填字母序號),收集時氨氣應從H裝置(填a或者b)導管口進,同時另一導管口最好與裝置相連接(填數字編號)。
【答案】
(1)酒精燈,錐形瓶,分液漏斗
(2)A,高錳酸鉀 ![]() 錳酸鉀+二氧化錳+氧氣,試管口塞一團棉花,C
錳酸鉀+二氧化錳+氧氣,試管口塞一團棉花,C
(3)催化(加快反應速率),過氧化氫 ![]() 水+氧氣,偏大,包含了分液漏斗中滴下的液體體積
水+氧氣,偏大,包含了分液漏斗中滴下的液體體積
(4)B,E,將燃著的木條放在集氣瓶口,若木條熄滅則滿,氫氧化鈣+二氧化碳 ![]() 碳酸鈣+水,蠟燭由低到高依次熄滅
碳酸鈣+水,蠟燭由低到高依次熄滅
(5)A,b,①
【解析】解:(1)由圖可得分別為酒精燈、錐形瓶、分液漏斗;(2)為固體需加熱型選A ;高錳酸鉀 ![]() 錳酸鉀+二氧化錳+氧氣(KMnO4
錳酸鉀+二氧化錳+氧氣(KMnO4 ![]() K2MnO4+MnO2+ O2);為避免高錳酸鉀粉末被氧氣吹入導管使導管堵塞需在試管口塞一團棉花 ;要收集較純氧氣需用排水法;(3)二氧化錳在此反應中為催化劑起催化作用(加快反應速率);過氧化氫
K2MnO4+MnO2+ O2);為避免高錳酸鉀粉末被氧氣吹入導管使導管堵塞需在試管口塞一團棉花 ;要收集較純氧氣需用排水法;(3)二氧化錳在此反應中為催化劑起催化作用(加快反應速率);過氧化氫 ![]() 水+氧氣(H2O2
水+氧氣(H2O2 ![]() H2O+ O2);分液漏斗中滴下的液體也會占據容器內空間,因此應偏大;(4)為固液不需加熱型B ;二氧化碳密度比空氣大且易溶于水只能用向上排空氣法E收集;即要檢測瓶口是否有溢出的二氧化碳,可以將燃著的木條放在集氣瓶口,若木條熄滅則滿;利用二氧化碳能使石灰水變渾濁來檢測,氫氧化鈣+二氧化碳
H2O+ O2);分液漏斗中滴下的液體也會占據容器內空間,因此應偏大;(4)為固液不需加熱型B ;二氧化碳密度比空氣大且易溶于水只能用向上排空氣法E收集;即要檢測瓶口是否有溢出的二氧化碳,可以將燃著的木條放在集氣瓶口,若木條熄滅則滿;利用二氧化碳能使石灰水變渾濁來檢測,氫氧化鈣+二氧化碳 ![]() 碳酸鈣+水(Ca(OH) 2 + CO2
碳酸鈣+水(Ca(OH) 2 + CO2 ![]() CaCO3 + H2O);二氧化碳不支持燃燒且密度比空氣大,因此蠟燭由低到高依次熄滅 ;(5)為固體需加熱型A ;氨氣密度比空氣小,從b進,空氣從a排出;能吸收多余的氨氣又不會因為氣壓減小水被倒吸入集氣瓶或氣壓過大應選 ①。
CaCO3 + H2O);二氧化碳不支持燃燒且密度比空氣大,因此蠟燭由低到高依次熄滅 ;(5)為固體需加熱型A ;氨氣密度比空氣小,從b進,空氣從a排出;能吸收多余的氨氣又不會因為氣壓減小水被倒吸入集氣瓶或氣壓過大應選 ①。
所以答案是:(1)酒精燈、錐形瓶、分液漏斗;(2)A ;高錳酸鉀 ![]() 錳酸鉀+二氧化錳+氧氣;試管口塞一團棉花;C;(3)催化(加快反應速率);過氧化氫
錳酸鉀+二氧化錳+氧氣;試管口塞一團棉花;C;(3)催化(加快反應速率);過氧化氫 ![]() 水+氧氣;偏大;包含了分液漏斗中滴下的液體體積;(4)B;E;將燃著的木條放在集氣瓶口,若木條熄滅則滿;氫氧化鈣+二氧化碳 → 碳酸鈣+水;蠟燭由低到高依次熄滅;(5)A;b;①。
水+氧氣;偏大;包含了分液漏斗中滴下的液體體積;(4)B;E;將燃著的木條放在集氣瓶口,若木條熄滅則滿;氫氧化鈣+二氧化碳 → 碳酸鈣+水;蠟燭由低到高依次熄滅;(5)A;b;①。


 全優點練單元計劃系列答案
全優點練單元計劃系列答案科目:初中化學 來源: 題型:
【題目】下列各組物質按單質、氧化物、混合物的順序排列的是( )
A. 海水、氧化鎂、氫氣B. 氮氣、冰水混合物、白酒
C. 空氣、二氧化碳、果汁D. 鎂、四氧化三鐵、氯化鈉
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】長期敞口存放石灰水的容器內壁上的白色物質和除去它的物質化學式為
A.Na2CO3 HClB.Ca(OH)2 HClC.CaCO3 HClD.CaO HCl
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】早在春秋戰國時期,我國就開始生產和使用鐵器。工業煉鐵把鐵礦石和焦炭、石灰石一起加入高爐,在高溫下,利用焦炭與氧氣反應生成的一氧化碳把鐵從鐵礦石里還原出來。
(1)一氧化碳還原氧化鐵的化學方程式為:。其中,石灰石起的作用是。
(2)(一)甲組同學在學習煉鐵的相關內容時,對煉鐵時還原劑的選擇進行了如下探究。
【提出問題】
單質碳也具有還原性,碳還原氧化鐵的化學方程式為。為什么工業上不用焦炭作為還原劑直接還原鐵礦石?
(3)【猜想與假設】
焦炭和鐵礦石都是固體,接觸面積小,反應不易完全。
【進行實驗】
①稱取兩份相同質量的氧化鐵粉末。一份與足量的碳粉均勻混合放入圖1裝置A的試管中;另一份放入圖1裝置B的玻璃管中。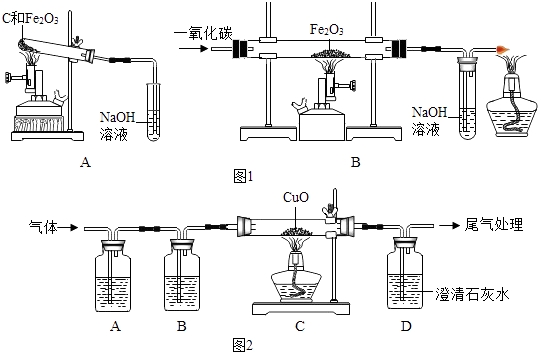
②圖1裝置A和B兩組實驗同時開始進行。在圖1裝置B的反應中,實驗開始前應先(選填“通CO”或“加熱”); 實驗結束后應繼續通入CO直至冷卻至室溫,其原因是。
(4)【實驗現象】
當圖1裝置B的玻璃管中固體完全由時(選填“紅色變為黑色”或“黑色變為紅色”),圖1裝置A的試管中仍有。
(5)【解釋與結論】
焦炭和鐵礦石都是固體,接觸面積小,反應確實不易完全,這可能是工業上不用焦炭作為還原劑直接還原鐵礦石的一個原因。
【完善實驗】
聯想到單質碳的一些化學性質,甲同學認為在碳還原氧化鐵的反應中可能還會有CO產生。為了證明碳還原氧化鐵所得的氣體中含有CO和CO2 , 將該氣體通過圖2的檢驗裝置。圖2A裝置中的試劑是(寫名稱,下同) , 圖2B裝置中的試劑是氫氧化鈉溶液,用以吸收二氧化碳(2NaOH+CO2═Na2CO3+H2O );證明原混合氣體中CO2存在的化學方程式;證明原混合氣體中CO存在的實驗現象是;經過檢驗,證實碳還原氧化鐵所得的氣體中確實含有CO和CO2。
(6)(二)精還原鐵粉是一種重要的化工原料,某興趣小組對其進行下列研究:
【物質制備】
利用綠礬制備精還原鐵粉的工藝流程如下:![]()
粗還原鐵粉中還含有少量鐵的氧化物和Fe3C雜質,可用氫氣在高溫下進一步還原,其反應方程式為FexOy+yH2 ![]() xFe+yH2O,Fe3C+2H2
xFe+yH2O,Fe3C+2H2 ![]() 3Fe+CH4。
3Fe+CH4。
【含量測定】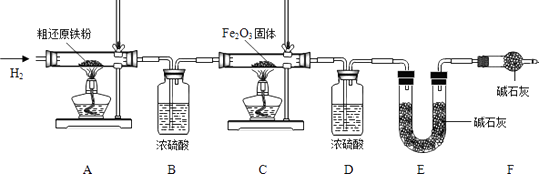
為得到精還原鐵粉并測定粗還原鐵粉中氧和碳元素的質量分數,按圖裝置進行實驗。
已知3CH4+4Fe2O3 ![]() 3CO2+6H2O+8Fe(假設每步反應都完全,且不考慮裝置內原有空氣對測定結果的影響)。
3CO2+6H2O+8Fe(假設每步反應都完全,且不考慮裝置內原有空氣對測定結果的影響)。
主要實驗步驟如下:
①按順序組裝儀器,檢查裝置的氣密性,稱量樣品和必要裝置的質量;
②緩緩通入純凈干燥的H2;
③點燃酒精燈,(填“先點A處,后點C處”或“先點C處,后點A處”);
④分別熄滅A處、C處酒精燈;
⑤再緩緩通入少量H2;
⑥再次稱量必要裝置的質量
(7)步驟②的目的是 , 驗證該步驟目的達到的實驗方法是;
(8)若缺少裝置D,則所測氧元素的質量分數將(填“偏大”,“偏小”或“不變”)。
(9)粗還原鐵粉樣品的質量為15.000g,裝置B、E分別增重0.270g和0.330g,則計算樣品出中碳、氧元素的質量分數分別是。(列出計算過程)
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列物質的性質和用途,對應關系不正確的是鎂
A | B | C | D | |
物質 | 鎂 | 氮氣 | 氧氣 | 稀有氣體 |
性質 | 燃燒時發耀眼白光 | 穩定性 | 供給呼吸 | 通電發光 |
用途 | 照明彈 | 氮肥 | 醫療上急救病人 | 霓虹燈 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】從分子的角度看,下列現象不可能發生的是( )
A. 放在衣柜里的衛生球不翼而飛 B. 嚴冬的自來水管中的水若結冰,則水管容易破裂
C. 不小心打破水銀溫度計,若不及時清理,可能發生汞中毒 D. 50毫升糖水和50毫升鹽水混合,體積大于100毫升
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com