
【題目】在A+3B=2C+2D的反應中,14克A完全反應生成44克C和18克D,若A的相對分子質量為28,則B的相對分子質量是
科目:初中化學 來源: 題型:
【題目】富含淀粉的谷物、甘薯等可以釀酒.在釀酒過程中淀粉在酶的作用下轉化為葡萄糖,葡萄糖發酵為酒精.香甜的酒釀就是利用該原理,用酒曲酶(俗稱酒藥)制作的.家庭一般制作酒釀的簡單流程圖如下(注:有機反應化學方程式可用箭號表示):
![]()
(1)配平化學方程式:(C6H10O5)n(淀粉)+________H2O![]() nC6H12O6(葡萄糖).
nC6H12O6(葡萄糖).
(2)如溫度、水分等因素控制不當,易導致乳酸量過多而味偏酸,請完成該反應的化學方程式:C6H12O4(葡萄糖)![]() 2________(乳酸).
2________(乳酸).
(3)成熟的酒釀放置時間越長酒味越濃,因為更多的葡萄糖在酒化酶作用下發酵分解為酒精(C2H5OH)和二氧化碳,寫出該反應的化學方程式:________________________________________________.
(4)若用1kg大米釀米酒,假設其中有0.81kg的淀粉全部轉化為酒精,則理論上可釀制含酒精質量分數為10%的米酒________kg.
[提示]由淀粉轉化為酒精的關系式為(C6H10O5)n~2nC2H5OH.
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖為某抗酸藥的實物圖,回答下列問題.

(1)圖中標示的物質中,含有的金屬元素是________(寫出一種即可),屬于有機合成材料的是________.
(2)淀粉屬于________(填字母序號).
a.蛋白質
b.糖類
c.油脂
d.維生素
(3)圖中的塑料包裝廢棄后可用于微型實驗.如鑒別氫氧化鎂和碳酸氫鈉(均可作抗酸藥)兩種白色粉末時,可分別取少量樣品放入廢棄包裝的兩個孔穴中,再滴入________(填試劑名稱),有________(填現象)的,原物質是碳酸氫鈉.
(4)另一種抗酸藥的主要成分是三硅酸鎂,其化學式為Mg2Si3O8·nH2O,能與鹽酸發生復分解反應,則反應后產物中含鎂的化合物是________(填化學式).
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如果將物質按單質、氧化物、酸、堿、鹽、有機物分類,下圖中甲、乙、丙是三種不同類別的物質,且相連物質間均能發生化學反應,下列說法符合圖示要求的是( )
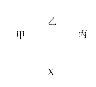
A.當甲為氯化銨時,X可以為氫氧化鉀
B.當甲、乙、丙分別為酸、堿、鹽時,X一定不可能為碳酸鈉
C.當X為氧氣時,甲、乙、丙可以為氫氣、紅磷、葡萄糖
D.當X為稀鹽酸時,甲、乙、丙可以為銅、氫氧化銅、硝酸銀
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】現有X、Y、Z三種金屬,將X、Y分別放入稀硫酸中,結果Y表面產生氣泡,X表面無明顯現象;另取X放入Z的鹽溶液中,結果X表面有Z析出。則X、Y、Z三種金屬的活動性順序是
A.Y>Z>X B.X>Y>Z C.X>Z>Y D.Y>X>Z
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某廠排放的廢水中含有碳酸鈉,易造成環境污染.化學興趣小組為該廠設計廢水處理和利用的方案,進行了如下實驗:取過濾后的水樣200g,逐滴加入稀鹽酸至恰好不再產生氣體為止,反應過程中生成氣體與所加稀鹽酸的質量關系如圖所示.回答下列問題(不考慮水樣中雜質的影響):
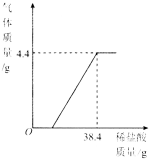
(1)反應生成CO2氣體的質量是________g.
(2)反應后生成氯化鈉的質量是多少?(寫出計算過程)
(3)農業上常用10%~20%的氯化鈉溶液來選種.請通過列式計算判斷:上述實驗恰好完全反應后所得溶液能否直接用于農業上選種?
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】明膠常應用于制藥和食品工業,其所含的一種蛋白質在人體內水解,可得產物之一是苯丙氨酸(C9H11O2N)。下列關于苯丙氨酸的說法正確的是
A.屬于氧化物
B.由C、H、O、N四種元素組成
C.由23個原子構成
D.各元素的質量比為9∶11∶2∶1
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(10分)“氯堿工業”是我國目前化學工業的重要支柱之一,它的主要原理是電解飽和食鹽水,其化學方程式為: x NaCl+ 2 H2O![]() x NaOH+ H2↑+ Cl2↑。在20℃時,取100g飽和NaCl溶液進行電解,一段時間后測得產生氯氣(Cl2)的質量為7.1g。(已知:20℃時,NaC1的溶解度為36g)請分析并計算回答:
x NaOH+ H2↑+ Cl2↑。在20℃時,取100g飽和NaCl溶液進行電解,一段時間后測得產生氯氣(Cl2)的質量為7.1g。(已知:20℃時,NaC1的溶解度為36g)請分析并計算回答:
(1)運用質量守恒定律可知上述反應中x= 。
(2)通過計算,上述過程中同時產生H2的質量為 g。
(3)計算電解后剩余溶液中NaC1的質量分數(寫出詳細的計算過程,結果精確到0.1%)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com