
【題目】如圖是實驗室制取氣體的有關裝置圖,據圖回答下列問題:
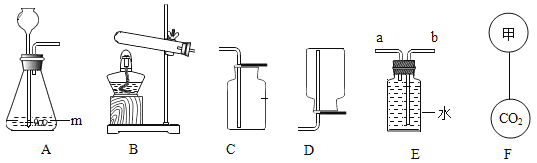
(1)寫出圖中標號儀器的名稱:m __________。
(2)若用大理石與稀鹽酸反應制取CO2,則反應的化學方程式為__________________ 。收集裝置為______ 。
(3)若用高錳酸鉀制取氧氣,選用的發生裝置為______(填裝置序號,下同),則反應的化學方程式為___________________________________ 。若用E裝置收集氧氣,氧氣應從________(填“a”或“b”)端通入。
(4)若要F中的兩個氣球懸浮在空氣中,則甲可能是________(填序號)。
a.空氣 b.氧氣 c.氫氣
(5)興趣小組探究了影響大理石與稀鹽酸反應劇烈程度的因素.
【查閱資料】反應物的濃度越大,反應速率越快.
【實驗過程】(注:鹽酸足量)
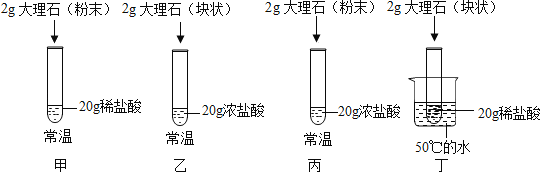
【實驗分析】
①若要探究鹽酸濃度大小對反應的影響,可選擇實驗甲與____對照(選填實驗編號)。
②除鹽酸濃度大小外,上述實驗研究的另兩個影響反應的因素是___和______________。
【交流討論】與甲比較,對丙的分析,錯誤的是__(選填編號)。
A、反應更為劇烈 B、產生的二氧化碳速度更快 C、產生的二氧化碳的質量更大
【答案】 錐形瓶 CaCO3+2HCl==CaCl2+H2O+CO2↑ C B 2KMnO4=K2MnO4+MnO2+O2↑, a c 丙 溫度 反應物顆粒大小(反應物之間接觸面積大小) C
【解析】(1)根據常見儀器解答;(2)根據碳酸鈣與稀鹽酸在常溫下反應生成氯化鈣、水和二氧化碳及二氧化碳密度比空氣大解答;(3)根據高錳酸鉀在加熱的條件下分解生成錳酸鉀、二氧化錳和氧氣及氧氣的密度比空氣大解答;(4)根據二氧化碳的密度比空氣大,則甲中氣體的密度必須必空氣小解答;(5)根據控制變量法分析解答。(1)圖中標號為m儀器的名稱是錐形瓶;(2) 碳酸鈣與稀鹽酸在常溫下反應生成氯化鈣、水和二氧化碳,反應的化學方程式為CaCO3+2HCl=CaCl2+H2O+CO2↑;收集裝置為C;(3) 用高錳酸鉀制取氧氣,選用的發生裝置為B,反應的化學方程式為2KMnO4△K2MnO4+MnO2+O2↑;氧氣的密度比空氣大,若用E裝置收集氧氣,氧氣應從a端通入;(4) 若要F中的兩個氣球懸浮在空氣中,由于二氧化碳的密度比空氣大,則甲中氣體的密度必須必空氣小,則甲可能是氫氣。故選c。(5) 【實驗分析】①根據控制變量法可知,除鹽酸濃度不同外,其余各量均應相同,因此可選擇實驗甲與丙對照;②根據控制變量法可知,除鹽酸濃度大小外,上述實驗研究的另兩個影響反應的因素是溫度和反應物顆粒大小(反應物之間接觸面積大小);【交流討論】與甲比較,丙中鹽酸濃度比甲高,其余條件全部相同,故反應更為劇烈,產生的二氧化碳速度更快。而鹽酸的質量與所用大理石的質量均相同,產生二氧化碳的質量相等。故選C。


科目:初中化學 來源: 題型:
【題目】如圖A為碳還原氧化銅的實驗裝置圖。老師指出反應物不同的質量比可能會影響生成物的種類,在學習時,可以從定性觀察和定量分析兩個角度來判斷生成物。請你跟隨老師的思路,探究碳還原氧化銅生成的氣體.(濃硫酸具有吸水性)
【提出問題】:碳還原氧化銅生成的氣體是什么?
【作出猜想】:猜想①:CO 猜想②:CO2猜想③:__________
【實驗設計】:裝置圖如圖:
方案一:從定性觀察角度判斷:
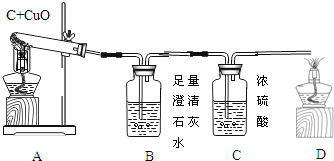
(1)若猜想3成立
Ⅰ、B處的現象是___________________
Ⅱ、D處發生反應的化學反應方程式___________________________
方案二:從定量計算角度判斷:
測定表格中的四個數據:
反應前的質量 | 反應后的質量 | |
裝置A | m1 | m2 |
裝置B | m3 | m4 |
Ⅰ、若猜想②成立,則m4m3___m1m2(選填“>”、“<”或“=”),此時A中的現象是__________________,B發生反應的化學方程式為 _________________________
Ⅱ、實際測量中B增加的質量小于理論值,請你分析可能的原因__________________________
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】根據下列粒子結構示意圖,回答問題。

(1)A、B、C、D所示粒子共表示______種元素(填數字)。
(2)D所示粒子在化學反應中容易_____電子(填“得到”或“失去”) 。
(3)若E中x=10 時,則該粒子屬于____(填“原子”或“離子”)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】專家提醒:燒烤攤里會吃出“癌癥風險”。腌制的肉串會產生一種叫做二甲基亞硝胺(C2H6N2O)的強致癌物質。請回答下列問題:
(1)該物質的相對分子質量為__________________________。
(2)該物質中碳元素和氮元素的質量比為_____________(答最簡整數比)。
(3)3.7g該物質中氮元素的質量為______________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】將質量相等的A、B、C三種金屬,同時分別放入三份溶質質量分數相同且足量的稀鹽酸中,反應生成H2的質量與反應時間的關系如圖所示。根據圖中所提供的信息,得出的結論不正確的是。(已知:A、B、C在生成物中均為+2價)

A. 放出H2的質量是A>B>C
B. 金屬活動性順序B>C>A
C. 消耗鹽酸的質量A>B>C
D. 相對原子質量是A>B>C
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】水在工業生產、生活以及化學實驗中起著重要作用。
(1)電解水實驗揭示了水的組成,反應的化學方程式為______________________,屬于_______反應(填基本反應類型)。
(2)自來水廠為提高沉降效果,通常要加入絮凝劑明礬,其化學式為KAl(SO4)212H2O,明礬由________種元素組成,其中屬于金屬元素的是____________(寫元素名稱)。
(3)水在化學實驗中的作用不可忽視,硫在氧氣中燃燒的實驗時,在集氣瓶中放少量水的目的是____。
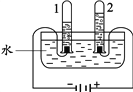
(4)下圖實驗證明可燃物燃燒需要與氧氣接觸的實驗現象是__________。
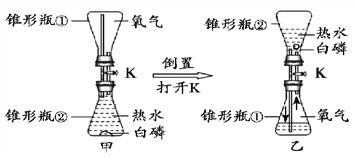
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】碳和碳的氧化物與我們的生活密切相關,請依據下圖回答問題:

(1)圖1是碳原子結構示意圖,其原子核內質子數為________,該元素在元素周期表中位于第_____周期。
(2)碳元素組成不同碳單質有廣泛的用途,圖2中用到的碳單質是________,圖3中用到的碳單質是____,圖4中用到的碳單質是________;不同碳單質物理性質存在明顯差異的原因是_____________。
(3)CO和CO2是碳的兩種氧化物。
CO可作燃料,其在空氣中燃燒的化學方程式是________________。
CO2可制飲料,其和水反應的化學方程式是__________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】鋼鐵是重要的金屬材料,在工農業生產和生活中應用非常廣泛。
I.鐵的應用
(1)下列鐵制品的利用與金屬導熱性有關的是_________________
A.鐵鉗 B.鐵鍋 C.刀具
(2)“納米α-Fe粉”可以用于食品保鮮,稱之為“雙吸劑”,因為它能吸收空氣中的_______。
II.鐵的冶煉
工業煉鐵的原理是高溫下用CO作還原劑,將鐵從氧化物中還原出來。請回答下列問題:
(1)寫出以赤鐵礦為原料,在高溫下煉鐵的化學方程式:______________;
(2)高爐煉鐵中,焦炭的作用除了可以生成一氧化碳外,還能____________。
Ⅲ.鐵的活動性探究
現用一定量的AgNO3和Cu (NO3)2混合溶液,進行了如下圖所示的實驗,并對溶液A和固體B的成分進行了分析和研究.
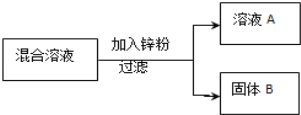
【提出問題】溶液A中的溶質可能有哪些?
【作出猜想】
①只有Zn(NO3)2
②有Zn(NO3)2、AgNO3
③有Zn(NO3)2、Cu(NO3)2
④有Zn(NO3)2、Cu(NO3)2、AgNO3
【交流討論】不合理的猜想是_______(填標號),其理由是__________
【實驗探究】根據如表中的實驗步驟及現象,完成表中的實驗結論
實驗步驟 | 現象 | 實驗結論 |
取少量固體B,滴加稀鹽酸 | 有氣泡產生 | 溶液A中的溶質成分符合猜想__, 固體B中的金屬成分有________種. |
Ⅳ.生鐵中鐵含量的測定
某課外興趣小組測定生鐵(含雜質的鐵,雜質既不溶于水也不溶于酸)中鐵的質量分數,他們取五份樣品,分別加稀硫酸反應.測得部分數據如下,請根據有關信息回答問題.
實驗次數 | 1 | 2 | 3 | 4 | 5 |
取樣品質量(g) | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 |
取稀硫酸質量(g) | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
產生氣體質量(g) | 0.2 | a | 0.6 | 0.8 | 0.9 |
(1)a的數值為_______________.
(2)第5次實驗結束后,所得到溶液中溶質的化學式為_________________.
(3)列式計算該樣品中單質鐵的質量分數是______________。
(4)所用稀硫酸的溶質的質量分數為____________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某興趣小組利用下列裝置進行氣體的制取實驗,請回答下列問題
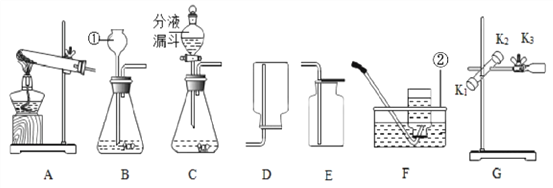
(1)寫出標號儀器的名稱:①_____;②______。
(2)用高錳酸鉀制取和收集較純凈的氧氣,選擇的裝置組合是____________(填字母),寫 出反應的化學方程式_______。
(3)如圖 G,要調節夾持試管的鐵夾的松緊,應調節旋鈕__________填“K1”“K2”或“K3”)
(4)實驗室制取二氧化碳的化學方程_______________,與 B 相 比,C 作為制取二氧化碳的發生裝置,優點是________。
(5)氫氣被認為是最清潔的燃料,現實驗室用 98g 質量分數為 10%的稀硫酸與足量鋅反應,最多生成氫氣的質量是________(寫出計算過程)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com