
【題目】在過氧化氫溶液的分解反應中,某化學興趣小組發現:除了二氧化錳,硫酸銅溶液也能對H2O2的分解起催化作用。對此,他們進行了有關探究。
(提出問題)CuSO4溶液是混合物,是其中哪一種成分起到了催化作用呢?
(查閱資料)①稀硫酸中主要含有H2O、H+、SO42三種微粒。
②CuSO4溶液中主要含有H2O、Cu2+、SO42三種微粒。
(作出猜想)根據以上信息,同學們作出了如下三個猜想:
Ⅰ:SO42催化分解H2O2 Ⅱ:Cu2+催化分解H2O2 Ⅲ:H2O催化分解H2O2
(1)其中,明顯不合理的是_______(填序號),理由是_______。
(實驗驗證)
(2)為了驗證自己的猜想,同學們設計了如下兩個實驗(所取H2O2溶液的濃度相同):
操作 | 現象 | 結論 |
取5 mL H2O2溶液于試管中,滴入少量的稀硫酸,伸入帶火星的木條 | _______ | SO42對H2O2的分解不起催化作用 |
_______ | 產生大量氣泡,帶火星的木條復燃 | _______ |
(實驗拓展)
實驗一:用圖甲裝置探究影響H2O2分解速率的因素,得到圖乙、圖丙所示曲線(在等溫條件下,產生氧氣體積與裝置內壓強成正比,反應放熱忽略不計)。
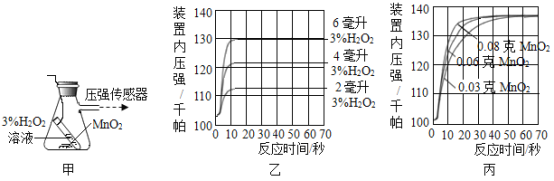
(3)寫出圖甲中反應的化學方程式_______。
(4)圖乙是“0.1 g MnO2與不同體積的3% H2O2溶液混合”的實驗結果,從圖中可以看出_______。
(5)圖丙是用“8 mL濃度為3%的H2O2溶液與不同質量的MnO2混合”時,所得到的曲線,通過該曲線可以得到的結論是_______。
實驗二:用圖丁裝置探究氧氣的濃度對燃燒的影響。點燃蠟燭后立即塞緊橡皮塞,待蠟燭熄滅后,將滴管中的水全部滴入瓶中,鋁盒中的白磷燃燒。
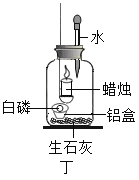
(6)白磷燃燒的主要現象是_______。
(7)由“蠟燭熄滅,白磷燃燒”可得出的結論是_______。
(8)滴入水后白磷燃燒的原因是_______。
【答案】Ⅲ H2O2溶液中就含有H2O,但并未加快產生氣泡的速率 無明顯氣泡,帶火星木條未復燃 取5 mL H2O2溶液于試管中,滴入少量CuSO4溶液,伸入帶火星木條 Cu2+對H2O2的分解起催化作用(或猜想Ⅱ正確) 2H2O2  2H2O + O2↑(催化劑可寫為“MnO2”) 過氧化氫用量越多,產生氧氣越多(或其它合理答案) MnO2的質量越大,產生氧氣的速率越快(或其它合理答案) 產生白煙,放出熱量 蠟燭燃燒所需氧氣濃度比白磷燃燒所需氧氣濃度要高(或蠟燭熄滅后,集氣瓶中仍有氧氣) 生石灰與水反應放熱,使溫度達到了白磷著火點
2H2O + O2↑(催化劑可寫為“MnO2”) 過氧化氫用量越多,產生氧氣越多(或其它合理答案) MnO2的質量越大,產生氧氣的速率越快(或其它合理答案) 產生白煙,放出熱量 蠟燭燃燒所需氧氣濃度比白磷燃燒所需氧氣濃度要高(或蠟燭熄滅后,集氣瓶中仍有氧氣) 生石灰與水反應放熱,使溫度達到了白磷著火點
【解析】
(1)猜想Ⅲ不可能的原因是H2O2中本來就有水,但沒有加快產生氣泡;
(2)滴入稀硫酸的目的是提供氯離子,結果木條沒復燃,說明不是SO42起的催化作用;在排除了SO42、H2O的干擾后,顯然是Cu2+的作用,通過模仿實驗一的方案設計可以選出加入的物質是CuSO4溶液,能夠提供銅離子,進一步驗證是Cu2+起的催化作用;
(3)裝置甲中過氧化氫在二氧化錳的催化作用下反應生成水和氧氣,發生反應的化學方程式為:2H2O2  2H2O + O2↑;
2H2O + O2↑;
(4)圖1乙是“0.1gMnO2與不同體積的3%H2O2溶液混合”的實驗結果,從圖中可以看出過氧化氫溶液越多,產生氧氣越多;
(5)圖丙是用“8mL濃度為3%的H2O2溶液與不同質量的MnO2混合”時,所得到的曲線,通過該曲線可知,在過氧化氫溶液的質量與濃度相同的條件下,二氧化錳的質量越大,生成氧氣的速率越快;
(6)白磷燃燒,放出熱量的同時產生了白煙;
(7)蠟燭熄滅后,白磷仍然能夠在集氣瓶中燃燒,說明蠟燭熄滅后,集氣瓶中仍然含有氧氣;
(8)在該實驗中,生石灰的主要作用是:生石灰與水反應放出大量的熱,溫度達到了白磷的著火點,引燃白磷。


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:
【題目】甲、乙兩物質的溶解度曲線如圖所示。下列敘述中,正確的是( )
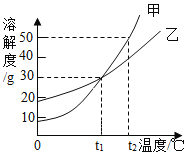
A. t1℃時,甲和乙溶解度均為30g
B. t2℃時,甲和乙的飽和溶液中溶質質量分數相等
C. t2℃時,在100g水中放入60g甲,其溶質的質量分數為37.5%
D. t2℃時,分別在100g水中各溶解20g甲、乙,同時降低溫度,甲先達到飽和
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】南海釣魚島及其附屬海域是我國固有領土,蘊藏著豐富的海洋資源,我國制堿工業先驅侯德榜發明了“侯氏制堿法”,在充分利用海洋資源的基礎上,結合“侯氏制堿法”的基本原理,可模擬實現工業生產純堿的過程如下(某些反應產物以略去):
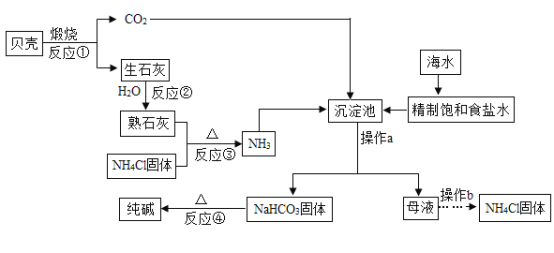
回答下列問題:
(1)操作a的名稱是____, 在該操作中常使用燒杯、玻璃棒和_______這三種玻璃儀。
(2)“侯氏制堿法”的主要產品“堿"是指_____ (填化學式)。
(3)在沉淀池中發生的反應是:將NH3、CO2、飽和氯化鈉溶液反應,生成NaHCO3固體和NH4Cl溶液,請寫出該反應的化學方程式____________________________。
(4)仔細觀察流程圖,其中可循壞利用的物質除二氧化碳之外,逐有_________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】探究實驗發現規律
(1)探究影響物質溶解性的因素.
實驗一 | 實驗二 |
|
|
實驗一目的是探究__________對硝酸鉀溶解性的影響; 實驗二觀察到的實驗現象為氯化鈉溶解于水,不能溶解于酒精中。該實驗的目的是探究__________對氯化鈉溶解性的影響.
(2)運用溶解度曲線信息回答下列問題:甲、乙、丙三種物質(均不含結晶水)的如圖所示,

①20℃時,甲、乙、丙三種物質溶解度由大到小的順序為__________。
②在__________時,甲和乙兩物質的溶解度相等。若丙中混有少量甲,可將其溶液__________結晶,趁 熱過濾以提純丙。
③50℃時,將等質量的甲、乙、丙三種物質的飽和溶液同時降溫至 10℃,所得溶液中溶質質量分數最小的是__________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖是探究金屬化學性質的四個實驗,有關敘述不正確的是( )
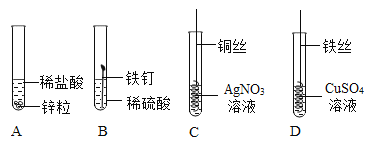
A.由①和②可以得出金屬活動性:Zn > Fe
B.由③和④可以得出金屬活動性:Fe > Cu > Ag
C.③中銅絲表面有銀白色物質析出,溶液變成藍色
D.②中反應的化學方程式為:Fe +H2SO4=FeSO4 +H2↑
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】閱讀下面科普短文。
黃石被稱為世界青銅文化的發祥地。青銅古稱“吉金”,多為金黃色,主要是銅、錫、鉛的合金。因其銅銹呈青綠色, 故名青銅。運用現代儀器分析青銅器及其銹蝕成分可以幫助我們對青銅器文物進行研究和保護。
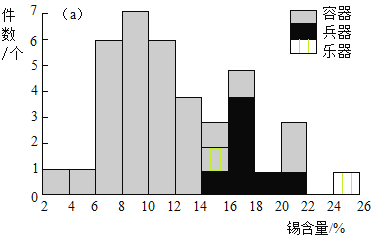
研究人員利用X射線能譜儀對我國西周晚期某墓地出土的青銅容器、兵器、樂器的成分進行了分析,其中錫含量的分布頻次如圖。
研究人員利用X射線衍射分析技術對“鎮國之寶”后母戊鼎西南足部位的銹蝕樣品進行分析,結果如下:
銹蝕成分 樣品編號 | Cu2Cl(OH)3 | Cu2O | Cu2CO3(OH)2 | SnO2 | 其他 |
1 | 98% | 2% | 0 | 0 | 0 |
2 | 5% | 95% | 0 | 0 | 0 |
3 | 29% | 34% | 12% | 0 | 25% |
4 | 61% | 0 | 4% | 9% | 26% |
上述成分中,堿式氯化銅[Cu2Cl(OH)3]對青銅文物的危害極大,器物一旦沾染上這種物質,在環境濕度適宜的條件下,就會像患上瘟疫一樣傳染和蔓延,將會造成潰爛、穿孔,直至徹底瓦解。
依據文章內容回答下列問題。
(1)青銅器屬于_________。
A 金屬材料 B 合成材料
(2)由錫含量的分布頻次圖推斷,某件青銅兵器的錫含量可能是_____
A 4% B 18%
(3)后母戊鼎西南足上的銹蝕成分中,Cu2O屬于__________。
A 氧化物 B 鹽
(4)堿式氯化銅[Cu2Cl(OH)3]的生成與環境中的氧氣、水和_________密切相關。
A 氯化物 B 二氧化碳
(5)請你對保存珍貴的青銅器提出一條合理化建議____________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖為三種物質的溶解度曲線。下列說法錯誤的是
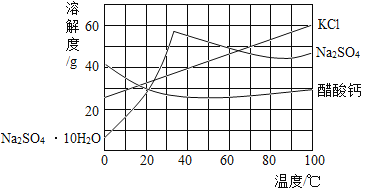
A.約在64℃時KCl和Na2SO4的溶解度相等
B.在室溫至100℃區間,隨溫度升高,Na2SO4的溶解度先增大后減小,醋酸鈣則相反
C.分離含少量KCl的Na2SO4溶液,采用先蒸發濃縮,后降溫結晶的方法
D.在40℃時,40gKCl固體溶于60g水得到40%KCl溶液
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】我國的北斗導航衛星系統采用銣原子鐘,提供精確時間。如圖是銣元素在元素周期表中的相關信息,下列說法正確的是
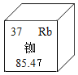
A. 銣元素屬于非金屬元素B. 銣元素的相對原子質量為85.47g
C. 銣原子的質子數等于中子數D. 銣元素的原子序數為37
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】利用下圖所示裝置研究氧氣的性質,并測定空氣中氧氣的含量。
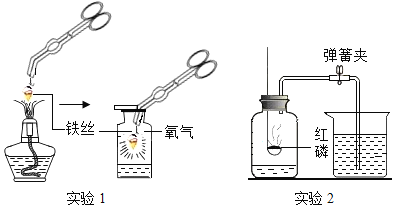
(1)實驗 1 中鐵絲發生了化學反應,證據是________________。該反應的化學方程式為__________________________。
(2)實驗 2 中,點燃紅磷前需要用彈簧夾夾緊膠皮管的原因是____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com