
【題目】金屬資源在生活中有著極其廣泛的應用。
(1)鋁的廣泛存在及應用
①鋁在地殼中的含量居所有金屬元素第_____位。
②鋁是很活潑的金屬,但用鋁制作的炊具卻耐腐蝕,其原因是_____(以方程式表示)。 長期使用鋁制炊具會使人體攝入過量的“鋁”,不利人體健康。這里的“鋁”是指_____。
a單質 b元素 c原子 d分子
③明礬中也含有鋁元素,生活中用明礬凈水的原理是_____。
(2)鐵的冶煉:圖1為某鋼鐵公司的礦石選取、冶鐵和煉鋼的工藝流程。
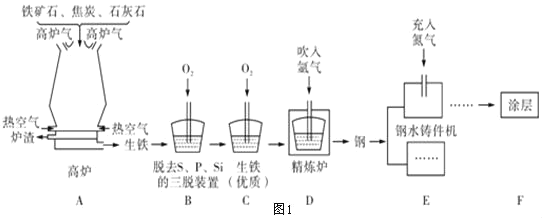
①用赤鐵礦石冶鐵的反應原理是_____(用化學方程式表示)。
②分析工藝流程,三脫裝置中發生反應的化學方程式是_____(任寫一個)。
③在鋼水鑄件機中,高溫鋼加工成鋼制零件時,充入氮氣的作用是_____。
(3)鐵的防護:某同學為探究鐵制品銹蝕的條件,進行如下實驗:
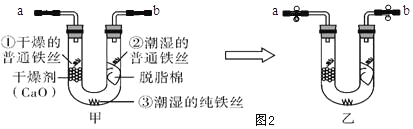
步驟 1:利用圖甲所示裝置,將干燥的O2從導管
a 通入U形管(裝置氣密性良好,藥品如圖甲所示);待U形管內充滿O2,用止水夾夾緊導 管a、b 處連接膠皮管,如圖乙所示。
步驟 2:一段時間后,觀察U形管內的鐵絲,其現象如表所示。
實驗序號及對象 | 現象 |
①干燥的普通鐵絲 | 沒有明顯變化 |
②潮濕的普通鐵絲 | 較多紅褐色銹斑 |
③潮濕的純鐵絲 | 沒有明顯變化 |
①步驟1中,如何證明U形管內O2已充滿?_____。
②水是鐵制品銹蝕的條件之一,此實驗中_____(填實驗序號)作對比能證明該結論。
③通過此實驗還可得出影響鐵制品銹蝕的因素是_____。
【答案】1 4Al+3O2═2Al2O3 b 吸附懸浮雜質,加速沉降 3CO+Fe2O3![]() 2Fe+3CO2 S+O2
2Fe+3CO2 S+O2![]() SO2 做保護氣 在b口放帶火星的木條,如果木條復燃,則裝滿氧氣 ① ② 水分和金屬的內部結構
SO2 做保護氣 在b口放帶火星的木條,如果木條復燃,則裝滿氧氣 ① ② 水分和金屬的內部結構
【解析】
根據鋁在地殼中的含量;鋁的性質和物質組成的表示方法;明礬溶于水生成物的特性;一氧化碳與氧化鐵在高溫條件下反應生成鐵和二氧化碳寫出反應的化學方程式;硫和氧氣點燃時生成二氧化硫寫出反應的化學方程式;氮氣的性質不活潑;氧氣具有助燃性來分析驗滿的方法;對比實驗的方法;對比實驗現象,分析影響鐵制品銹蝕的條件來分析。
(1)①鋁在地殼中的含量居所有金屬元素第1位。故填:1
②鋁是很活潑的金屬,但用鋁制作的炊具卻耐腐蝕,其原因是鋁易與空氣中的氧氣反應在其表面形成了致密的氧化鋁的薄膜,反應的化學方程式是:4Al+3O2═2Al2O3; 物質的組成常用元素來描述,長期使用鋁制炊具會使人體攝入過量的“鋁”,不利人體健康。這里的“鋁”是指元素;故填:4Al+3O2═2Al2O3;b
③明礬中也含有鋁元素,生活中用明礬凈水,是由于明礬溶于水生成的膠狀物具有吸附性,所以原理是:吸附懸浮雜質,加速沉降;故填:吸附懸浮雜質,加速沉降
(2)①一氧化碳與氧化鐵反在高溫條件下反應生成鐵和二氧化碳,方程式為:3CO+Fe2O3![]() 2Fe+3CO2;故填:3CO+Fe2O3
2Fe+3CO2;故填:3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
②分析工藝流程,三脫裝置中發生反應有硫和氧氣點燃生成二氧化硫,方程式是:S+O2![]() SO2;故填:S+O2
SO2;故填:S+O2![]() SO2
SO2
③氮氣的化學性質很穩定,在該操作中可以用作保護氣。故填:做保護氣
(3)①由于氧氣具有助燃性,步驟1中,檢查U形管內是否已充滿O2的方法是:在b口放帶火星的木條,如果木條復燃,則裝滿氧氣;故填:在b口放帶火星的木條,如果木條復燃,則裝滿氧氣
②在對比實驗中,變量應只有一個,所以水是鐵制品銹蝕的條件之一,此實驗中①②作對比能證明該結論;故填:① ②
③通過② ③對比實驗現象,此實驗還可得出鐵制品銹蝕的條件是:水分和金屬的內部結構,因為“潮濕的純鐵絲”和“潮濕的普通鐵絲”的變量是“有無碳和其他雜質”。故填:水分和金屬的內部結構


 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:初中化學 來源: 題型:
【題目】某同學模仿物理課上學到的“串聯電路”,設計如下氣體制取與性質驗證的組合實驗。打開分液漏斗活塞后,A中出現大量氣泡,B中白磷燃燒,C中液面下降,稀鹽酸逐漸進入D中。請看圖回答問題。
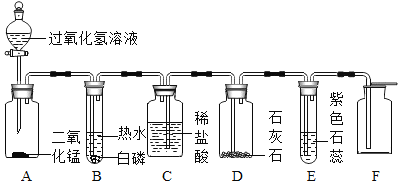
①裝置A中發生反應的化學方程式為_____;
②裝置B中白磷能夠燃燒的原因是_____;
③裝置E中的實驗現象是_____;
④裝置C中液面下降的原因是_____;
⑤用F裝置收集氣體的依是_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】為了研究可燃物的燃燒條件,某興趣小組同學用如圖所示裝置進行了實驗(白磷、紅磷均不超過綠豆大小,錐形瓶中的白磷A與紅磷C盡量拉開距離)。白磷的著火點為40℃,紅磷的著火點為240℃。

(1)寫出錐形瓶中發生的實驗現象:______________。
(2)結合本實驗目的,寫出燒杯70℃熱水的作用:______________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某校化學興趣小組參觀制堿廠后,獲得以下信息并對相關問題進行研究.
[查閱資料]
<資料1>該廠采用“侯氏制堿法”生產的化工產品為純堿(化學式為_____)和氯化銨.(“侯氏制堿法”是我國近代著名科學家侯德榜發明的一種連續生產純堿與氯化銨的聯合制堿工藝.)
<資料2>生產原料粗鹽中含有少量可溶性雜質(MgCl2和CaCl2)及不溶性雜質.
<資料3>部分生產流程如下圖所示.
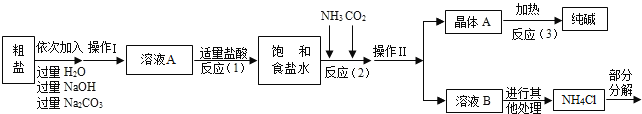
上述流程中涉及的部分反應的化學方程式為:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;Na2CO3+CaCl2=CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
生產原理:將氨氣(NH3)和二氧化碳通入飽和食鹽水中得到小蘇打和氯化銨的混合物,其反應的化學方程式為:NaCl(飽和溶液)+NH3+CO2+H2O=NaHCO3(晶體)↓+NH4Cl;分離出NaHCO3,使其充分受熱即可分解制得純堿及兩種常見的氧化物,此反應的化學方程式為_____.
(問題討論)
(1)溶液A中的溶質為_____,操作Ⅱ的名稱為_____.
(2)上述生產流程中可循環使用的是_____(填序號).
ACO2BNH3C.HCl DNaOH ENa2CO3
(3)根據上述信息,請你設計實驗區分碳酸鈉和碳酸氫鈉.
實驗步驟 | 實驗現象 | 實驗結論 |
_____ | _____ | _____ |
(含量測定)
同學們為了測定該純堿樣品的純度,設計了如下實驗.
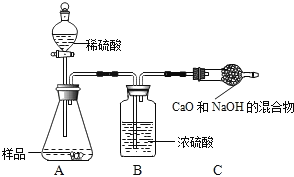
甲組:取10.0g純堿樣品(假定雜質在整個實驗過程中不發生變化),向其中加入過量的鹽酸,直至樣品中無氣泡冒出.充分加熱蒸發所得物質并干燥、冷卻至室溫后稱量,所得固體質量為10.9g.樣品中碳酸鈉的質量分數為_____(結果保留一位小數).
乙組:取10.0g純堿樣品,利用右圖所示裝置,測出反應后裝置C增重了3.5g(所加試劑均足量).
實驗結束后,發現乙組測定的質量分數偏小,其原因是_____.
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】近年各大體壇賽事報道頻繁出現一個名詞“嗅鹽”。某校興趣小組在老師的指導下,對“嗅鹽”展開了系列探究:
(查閱資料)①嗅鹽,是一種由碳酸銨和香料配制而成的藥品,給人聞后有刺激作用;
②嗅聞原理是碳酸銨晶體產生的氨氣對人體有刺激作用,過量嗅聞不利健康;
③碳酸銨[(NH4)2CO3]晶體受熱易分解,產生 NH3、H2O、CO2。
(定性初探)驗證“嗅鹽”的化學性質
(1)甲同學進行了NH4+的驗證實驗:取適量嗅鹽于試管中,加入氫氧化鈉溶液共熱,在試管口放一張_____,觀察到了預期的實驗現象。請寫出氫氧化鈉溶液與碳酸銨反應的化學方程式_____。
(2)乙同學進行了 CO32﹣的驗證實驗:取適量嗅鹽于試管中,再加入稀硫酸,并將生成的氣體通入_____,預期的實驗現象是_____,實驗后觀察到了預期的現象。
(定量再探)測定“嗅鹽”中碳酸銨(NH4)2CO3的質量分數
方案Ⅰ:取樣品 6.0 克,用圖 1 裝置進行實驗,測量C裝置在反應前后增加的質量即為產生NH4+的質量:
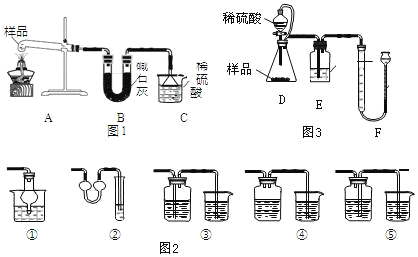
(3)裝置B的作用_____,裝置C中普通漏斗的作用是_____,圖2裝置中不能與其起到相似作用的是_____。
(4)小組同學經討論后,均認為用該套裝置測量會導致碳酸銨的質量分數偏小,原因是_____。
方案Ⅱ:取樣品6.0克,用圖3裝置進行實驗,利用F裝置測量反應生成氣體的體積。
(5)請寫出裝置D中發生反應的化學方程式_____,裝置 D 中橡膠管除平衡壓強,便于液體順利滴下外,還有_____的作用。
(6)該方案實驗結束后,會有氣體殘留,不能完全進入量氣管中,_____(填“需要”或“不需要”)通入N2將其 中殘留的氣體排入量氣管中,闡述你的理由_____。
(7)實驗測得量氣管中產生氣體的體積為 558mL,該方案所測嗅鹽中碳酸銨的質量分數為_____。(已知實驗條件下,CO2的密度約為 1.97g/L)。(請寫出過程,計算結果精確到 1%)
(8)若其他操作均正確,下列因素會導致所測嗅鹽中碳酸銨的質量分數偏大的是_____ (填字母)
a反應前量氣管液面在 0 刻度處以下
b實驗結束后,調節兩端液面相平讀數
c反應結束后未等裝置冷卻到室溫,就開始讀數
d反應前正確讀取量氣管中液體體積,反應后仰視讀數
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列關于物質結構和性質的說法中,不正確的是( )
A. 生鐵和鋼性能不同主要是由于含碳量不同
B. ![]() 和
和![]() 化學性質不同是由于構成它們的分子不同
化學性質不同是由于構成它們的分子不同
C. 金屬鈉和鋁的化學性質不同是由于鈉和鋁的原子結構不同
D. 金剛石、石墨和![]() 的物理性質不同是由于構成它們的碳原子不同
的物理性質不同是由于構成它們的碳原子不同
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】向盛有10 g純堿樣品(含有少量氯化鈉)的燒杯中加入稀鹽酸。加入80 g稀鹽酸時,恰好完全反應。反應后燒杯內物質總質量為86.7 g。
(l)該反應生成二氧化碳的質量為_________g;
(2)求該純堿樣品中碳酸鈉質量分數為___________(寫出計算過程)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】MgSO4·7H2O是一種重要的化工原料,某工廠以一種鎂礦石(主要成分為SiO2和MgCO3,還含有少量FeCO3)為原料制備MgSO4·7H2O的主要流程如下:
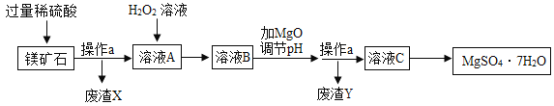
已知:SiO2既不溶于水也不溶于稀硫酸。請回答下列問題:
(1)“操作a”的名稱是______。
(2)“廢渣Y”中含有少量的FeOOH,其中鐵元素的化合價是______。
(3)MgCO3溶于稀硫酸的化學方程式為______。
(4)“溶液A”中加入H2O2溶液會生成Fe2(SO4)3,該反應的化學方程式為______。
(5)選用MgO調節pH使Fe3+轉化為沉淀,而不選用NaOH的原因是______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】以化合價為縱坐標,以物質的類別為橫坐標所繪制的圖象叫價類圖。如圖為鐵的價類圖,請分析該圖后填寫下列各空:
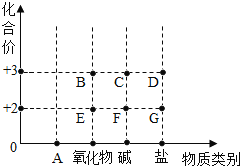
①A點表示的物質類別是_____,C點表示化合物的化學式為_____,它能與稀鹽酸反應,其反應的化學方程式為_____。
②某化合物的化學式為K2Fe(SO4) 2,則它代表的點是圖中_____(選填A、B、C、D、E、F、G)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com