
【題目】水是重要資源,下列說法不正確的是
A.煮沸和蒸餾均能使硬水轉化為軟水
B.活性炭的吸附作用可使海水轉化為淡水
C.電解水得到的H2和O2質量比為1∶8
D.液態水變成水蒸氣,分子間間隔增大
【答案】B
【解析】
A、煮沸和蒸餾過程中都需要加熱,在加熱過程中可溶性鈣鎂化合物會轉變成難溶于水的碳酸鈣和氫氧化鎂等物質,水中可溶性鈣鎂化合物含量降低甚至完全除去,硬水轉化為軟水,選項A正確;
B、活性炭只能吸附異味、色素等可溶性雜質,不能吸附海水中的鈉離子、鎂離子、氯離子,而海水淡化是要降低海水中可溶性鹽的含量,因此活性炭的吸附作用不能使海水轉化為淡水,選項B不正確;
C、電解水的化學方程式是: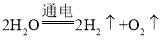 ,根據化學方程式,可以計算出H2和O2的質量比為1∶8,選項C正確;
,根據化學方程式,可以計算出H2和O2的質量比為1∶8,選項C正確;
D、構成物質的分子之間有間隔,液態物質中分子之間的間隔較小,氣態物質中分子之間的間隔較大。因此液態水變成水蒸氣,分子間間隔增大,選項D正確。故選B。


科目:初中化學 來源: 題型:
【題目】閱讀下面科普短文(原文作者:許謙,有刪改)
酸奶口感酸甜,營養豐富,是深受人們喜愛的一種乳制品。與普通牛奶比較,酸奶中的蛋白質和鈣更易被人體消化吸收,是乳糖不耐癥患者的良好食品。
通常的酸奶是將牛奶發酵而制成的。牛奶中主要含有蛋白質、乳糖和脂肪。在發酵過程中,乳酸菌把乳糖(C12H22O11)轉化成乳酸(C3H6O3),使得牛奶的酸度升高。隨著酸度增加,蛋白質分子互相連接,形成了一個巨大的“網絡”,這個“蛋白質網絡”把乳糖、水、脂肪顆粒都“網”在其中。所以,奶變“粘”、變“酸”了。

酸奶中含有大量活力較強的乳酸菌。乳酸菌可抑制某些腐敗菌和病原菌的繁殖,從而維持人體內,尤其是腸道內正常的微生態平衡,促進食物的消化吸收。酸奶在儲藏和配送過程中,乳酸菌的數量會因乳酸的過量積聚而明顯減少,而酸奶的乳酸積聚又會影響到酸奶的酸度。有研究者選取某種市面常見的酸奶進行實驗,數據如下表所示。
表某品牌酸奶酸度的變化
溫度/℃ 時間/天酸度/°T | 4 | 28 | 37 |
0 | 67.7 | 67.7 | 67.7 |
2 | 73.9 | 77.1 | 79.2 |
4 | 76.4 | 82.7 | 86.3 |
6 | 85.5 | 92.2 | 98.9 |
8 | 90.2 | 98.7 | 113.2 |
1999年頒布的國標GB2746-1999中,對成品酸奶的酸度規定為“酸度不小于70°T”。按照一般人的接受程度,酸奶酸度不能超過100°T。
依據文章內容回答下列問題。
(1)乳酸是由乳糖轉化生成的,請比較二者的化學式,分析它們的相同點和不同點。
相同點:_____。
不同點:_____。
(2)實驗中所用酸奶若在37℃條件下儲存,_____天后,酸度一定會超出一般人的接受程度。(填字母序號,下同)
A 2 B 4 C 5 D 8
(3)由表中實驗數據可知,影響酸奶酸度的因素有_____。
(4)下列關于酸奶的說法正確的是_____。
A 酸奶適用于乳糖不耐癥患者食用
B 酸奶放置時間越長,乳酸菌含量越高
C 酸奶中的乳酸菌對人類身體有害無益
D 酸奶變“粘”與蛋白質分子相互連接形成巨大“網絡”有關
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】甲、乙、丙、丁4種初中化學常見的物質,由氫、碳、氧、鈉中的1~3種元素組成。 用如圖所示裝置和試劑做了以下3個連續實驗。

已知:酚酞溶液遇Na2CO3溶液、NaHCO3溶液均呈紅色。
(1)打開K,將膠頭滴管中的水擠入集氣瓶中,振蕩集氣瓶,觀察到燒杯中的導管口有氣泡冒出,觸摸集氣瓶壁,感覺到微熱。
① 已知甲為白色固體,有強烈的腐蝕性,易潮解,則甲的化學式為_____。
② 燒杯中導管口有氣泡冒出的原因是_____。
(2)關閉K,打開集氣瓶塞,將少量黑色固體乙點燃后,立即伸入瓶中,塞緊瓶塞,觀察到乙在丙中劇烈燃燒,發出白光。燃燒產物丁分子的微觀示意圖為![]() ,則丙分子的微觀示意圖為_____。
,則丙分子的微觀示意圖為_____。
(3)待乙充分燃燒至熄滅后,冷卻至室溫,振蕩集氣瓶后,打開K,觀察到燒杯中的溶液沿導管進入集氣瓶,瓶中產生大量氣泡。
①燒杯中的溶液進入集氣瓶后產生氣泡的原因_____(用化學方程式解釋)。
② 充分反應后,集氣瓶內溶液為無色,則溶液中的溶質除酚酞、NaCl外,還可能有_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖為甲、乙、丙三種固體物質的溶解度曲線,請回答.
(1)在 ℃時,甲、乙溶解度相等.
(2)甲中混有少量乙,若要提純甲可采取的結晶方法是 .
(3)t2℃時,丙的飽和溶液中溶質和溶劑的質量比為 .
(4)將t3℃的甲、乙飽和溶液降溫到t1℃,析出固體甲的質量 (填“一定”或“不一定”)大于乙.

查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】除去下列各組物質中的少量雜質,所用方法不正確的是:
選項 | 物質 | 雜質 | 除去雜質的方法 |
A | NaCl | Na2CO3 | 加入足量的稀鹽酸不再有氣體產生,蒸發 |
B | N2 | O2 | 通過紅熱的銅絲 |
C | KNO3溶液 | Ba(NO3)2 | 滴加適量K2SO4溶液、過濾 |
D | Ca(OH)2 | CaCO3 | 滴入足量稀鹽酸至不再產生氣體 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】請根據下列裝置回答問題:
(1)寫出①、②的儀器名稱:①______________;②_____________。
(2)實驗室用高錳酸鉀制取氧氣的化學方程式為____________,若用B裝置制氫氣,則B中反應的化學方程式__________。
(3)實驗室可用B裝置來制取二氧化碳,反應的化學方程式為__________,若用碳酸氫鈉固體加熱分解(產物為碳酸鈉、二氧化碳和水)來制取CO2,應選用的氣體發生裝置是_____(填字母)。
(4)用E裝置可以收集O2、CO、CH4等氣體中的_______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】人類文明的發展和社會的進步同金屬材料關系十分密切,其中鋼鐵是基本的結構材料,稱為“工業的骨骼”。
(1)自行車的有些部件是由鋼鐵制成的。鋼鐵制品被腐蝕的原因,是其與_____接觸引起的,為防止自行車鏈條生銹可采取的措施是_____。
(2)金屬鋰是密度最小的金屬,用于原子反應堆、制輕合金及電池等。鋰(Li)的原子結構示意如圖1所示,它的化學性質與鈉相似,原因是_____。請寫出鋰與稀硫酸反應的化學方程式:_____。
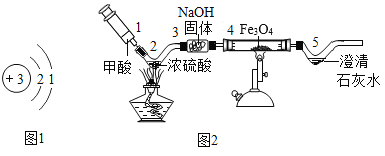
(3)同學們利用自制儀器模擬工業煉鐵實驗,用圖2所示微型實驗裝置制取CO,然后用CO還原Fe3O4并檢驗氣體產物。已知甲酸(HCOOH)具有揮發性,在熱的濃硫酸中分解生成一氧化碳和水。
①位置4發生的化學方程式是_____。
②氫氧化鈉固體的作用是什么?_____。
③本實驗存在明顯缺陷,請給出優化建議_____(寫出一點即可)。
(4)工業上可利用鋁和氧化鐵在高溫下發生置換反應制得鐵來焊接鋼軌。若用足量鋁與40kg氧化鐵反應,理論上可制得鐵的質量是多少_____?
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】鎂在國產大飛機“C919”的制造中大顯身手。實驗室模擬“海水制鎂”的原理來富集鎂,將20g氯化鈉和氯化鎂的固體混合物全部溶解于盛有100g水的燒杯中,然后向其中加入80g氫氧化鈉溶液,恰好完全反應,過濾,稱量濾液質量為194.2g,請計算:
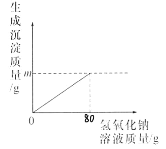
(1)圖象中m=_____g;(結果精確到0.1g)。
(2)濾液中溶質的質量分數是多少____?(結果精確到0.1%)?
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下面是同學們測定黃銅(銅鋅合金)中銅的質量分數的過程。
(1)小華同學取10g黃銅,加入足量的稀硫酸,共收集到氣體0.2g,則黃銅中銅的質量分數是多少?____________________(寫出計算過程)
(2)小婷同學另取10g黃銅于燒杯中,向燒杯中加入稀硫酸,測得加入的稀硫酸質量和燒杯中剩余物的質量如下表:
加入稀硫酸的質量/g | 30 | 60 | 90 | 120 |
燒杯中剩余物的質量/g | 39.94 | m | 99.82 | 129.8 |
①表中m=____________,從表中的數據分析,當小婷同學加入_________g稀硫酸時,燒杯中剛好沒有氣泡產生。
②請在下圖畫出10g黃銅加入稀硫酸與生成氫氣的質量的圖像____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com