
科目: 來源: 題型:
【題目】19世紀末,科學家瑞利通過如下兩種方法制得氮氣,并測得其密度,從而獲得科學史上的重大發現。請你參與以下的科學發現過程。
方法I:利用空氣分離出氮氣
實驗步驟 | 解釋或結論 |
(1)將清新潔凈的空氣通過NaOH溶液,再通過濃硫酸。 | 通過濃硫酸的 目的是為了除去空氣中的_____________。 |
(2)將氣體通過能與氧氣反應的物質(提示:反應不能生成新的氣體) | 請寫 出一種能用于除去氧氣的物質____________。 |
(3)收集剩余氣體,并測定該氣體的密度。 | 密度: 1.2572g/L |
方法Ⅱ:用亞硝酸鈉(NaNO2)和氯化銨(NH4Cl)反應制取氮氣,同時還生成了氯化鈉和一種常見的液態物質(反應裝置如下圖所示,其中B部分的冰鹽起冷凝作用)。測得氮氣的密度為1.2508g/L.該反應的化學方程式為_____________________________。
[實驗驗證]實驗小組同學采用方法Ⅱ測定氮氣的密度,操作步驟如下:
① 20°C時,經過必要的實驗操作后,取含NH4Cl固體0.214g的飽和NH4Cl溶液放入燒瓶,連接裝置;
② 調節水準管,使其與量氣管中液面相平,記錄量氣管中水面讀數為10.0mL;
③打開分液漏斗的活塞,逐滴滴入飽和NaNO2溶液,加熱至反應發生,移走酒精燈:
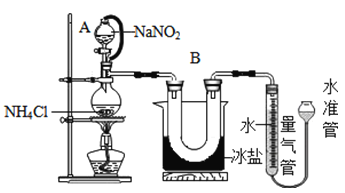
④ 燒瓶中不再產生氣泡時,關閉分液漏斗A的活塞;
⑤待冷卻至室溫,調節兩邊液面高度相平,記錄量氣管中水面讀數為100.0mL;
⑥處理剩余藥品,整理實驗臺。
[實驗分析及數據處理]
(1)步驟①中加入藥品前必須進行的實驗操作是_________________;
(2)步驟③中移走酒精燈后,實驗可持續進行的原因是_________________;
(3)計算該實驗中生成的氮氣的密度為___________________g/L(保留4位小數)
[解釋與結論]瑞利(Rayleigh)發現,采用方法Ⅰ得到的氮氣在相同條件下比其他方法得到的純氮氣密度總是偏大0.5%~ 0.6%。若實驗設計與操作均無錯誤,且氮氣已完全干燥,請解釋產生這一現象的原因是________________;(已知:相同條件下,氣體的相對分子質量越大,密度就越大)
[反思與評價]
(1)裝置中A部分的分液漏斗與蒸餾燒瓶之間連接的導管所起的作用是____
A 防止NaNO2飽和溶液蒸發
B 保證實驗裝置不漏氣
C 使NaNO2飽和溶液順利滴下
D 使測得的N2體積更準確
(2)科學家瑞利僅僅是從小數點第三位數的差別,發現了新物質。這啟示我們在今后的學習和生活中要學習科學家的______________。
A 嚴謹求實的科學態度和敢于懷疑的批判精神
B 科學研究中遇到疑惑就趁早放棄,不要浪費時間
C 不能因為微小的差異而放過一次成功的機會
D 要相信權威,權威一定是正確的
(3)在實驗室中,我們也可將氨氣通過熾熱的裝有氧化銅的硬質玻璃管,生成銅、氮氣和水蒸氣,該反應的化學方程式為_______________________,若實驗操作正確,除去水蒸氣,經過精確測定,用該方法測得的氮氣密度數值應與上述方法__________________ (填“I”或“II”)的更接近。
查看答案和解析>>
科目: 來源: 題型:
【題目】根據如圖回答問題。

(1)儀器a的名稱是________________;
(2)實驗室制取二氧化碳的發生和收集裝置是_________________;發生反應的化學方程式為_____________;若該實驗需要制取44g二氧化碳,實驗室只有100g 大理石和足量稀鹽酸,請通過計算說明能否完成實驗任務? _________________;
(3)實驗室用A裝置制氧氣的化學方程式為__________________。裝置E中的實驗現象是____________________;發生反應的化學方程式為___________________。
(4)探究帶火星的木條在不同體積分數氧氣中的復燃情況,部分實驗數據記錄如表所示。
氧氣體積分數(%) | 30 | 40 | 60 | 70 |
帶火星的木條 | 不變 | 稍亮 | 復燃 | 復燃 |
在集氣瓶中注入占其容積50%的水(如圖F所示),用排水法收集完氧氣后,將帶火星的木條伸入該集氣瓶中,推測實驗現象為_________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】觀察下列原子結構示意圖和元素周期表(部分),回答有關問題。
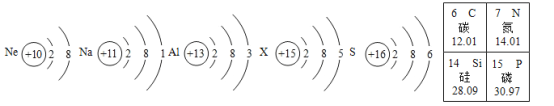
(1)具有相對穩定結構的原子是______,屬 于金屬元素的是______________________。
(2)含有X元素的化合物常用作化肥,X元素的原子序數是_____,相對原子質量為______________________。
(3)高純度的晶體硅是制作芯片的重要物質,它是由____________________(填微粒名稱)構成的。
(4)在某金屬單質與硫反應的過程中,硫原子得到2個電子形成硫離子。下列說法正確的是______________________(填字母序號)。
A 硫離子屬于陰離子
B 硫離子的核外電子數與質子數相等
C 硫離子可表示為S2+
D “S”既可以表示硫原子,也可以表示硫元素
查看答案和解析>>
科目: 來源: 題型:
【題目】根據下列實驗,回答問題:
實驗一:為了探究氨氣(NH3)的某些性質,小雨同學根據學過的知識,依次做了以下實驗。
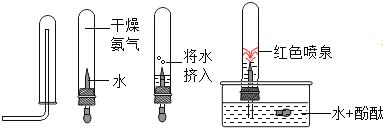
由以上實驗,得出氨氣的物理性質還有________________;__________________。
實驗二:通過電解水實驗研究水的組成
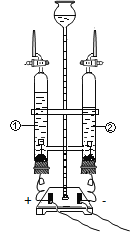
(1)電解水的實驗如圖所示,收集到氧氣的是玻璃管_______________(填“①”或“②”),該反應的化學方程式是_________________;該實驗說明水是由___________組成的。
(2)電解水的微觀示意圖如圖,請在方框中補全相應微粒的圖示_______________。
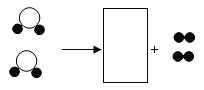
實驗三:從含有CuSO4和FeSO4的廢液中回收Cu和FeSO4溶液。
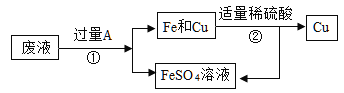
(1)①中分離操作的名稱是___________________;
(2)②中反應的化學方程式是_____________________;該反應屬于基本反應類型中的_____________反應。
(3)不考慮過程中鐵元素的損耗,最終得到的FeSO4溶液中鐵元素的質量__________________(填“>”“<”或“=”)廢液中鐵元素的質量。
查看答案和解析>>
科目: 來源: 題型:
【題目】化學與我例如影相隨,滲透到我們生活的各個角落,為我們服務。
(1)如圖為某品牌仿生滅蚊燈,它通過三重方式誘蚊:燈管內發出的紫光波;紫光源照射光觸媒涂層釋放二氧化碳和水,模擬人的呼吸:燈內加入與人體汗液相似的含有乳酸(C3H6O3)、硬脂酸(C18H36O2) 的誘餌。

①人呼出的氣體與吸入的空氣相比含量增多的有_______________________;
②C3H6O3中碳、氫、氧三種元素的質量比為_______________________;
③二氧化碳、水、硬脂酸三種物質中,屬于氧化物的是_________________________。
(2)我們的藥品都是重要的化學物質。如圖是硫酸鎂注射液的部分說明書。
計算硫酸鎂(MgSO4)的相對分子質量為______________ ;并標注硫元素的化合價為___________________。

查看答案和解析>>
科目: 來源: 題型:
【題目】鈦(Ti)具有良好的耐熱性和耐腐蝕性,其一個原子中質子數為22。以金紅石(主要成分是TiO2)為原料生產鈦的步驟主要有:① 在高溫下,向金紅石與焦炭(C)的混合物中通入氯氣(Cl2),得到TiCl4和一種可燃性氣體;② 在稀有氣體環境和加熱條件下,用Mg與TiCl4反應得到Ti和MgCl2。下列說法不正確的是
A.一個鈦原子中核外電子數為22
B.①中得到的可燃性氣體為CO
C.②中稀有氣體的作用是隔絕空氣
D.②中發生的反應為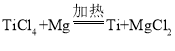
查看答案和解析>>
科目: 來源: 題型:
【題目】鐵及其化合物在生產生活中應用廣泛。
(一)鐵的性質和應用
(1)某麥片中含微量鐵粉,食用后鐵粉與胃酸(含HCl)反應轉化為人體可吸收的鐵元素,反應的化學方程式為_____________________;
(2)人體缺Fe2+影響健康(已知: Fe2+在空氣中 易被氧化成Fe3+)。
①琥珀酸亞鐵(化學式: FeC4H4O4)是常用補鐵劑,其相對分子質量為_____________________;
②硫酸亞鐵糖衣片亦能補鐵,糖衣除包裝藥物外,另一作用是_____________________;高鐵酸鉀是高效殺菌凈水劑,反應原理為: ![]() 。 x的化學式為_____________________;
。 x的化學式為_____________________;
(3)鐵生銹的次要過程:
![]()
寫出Fe轉化為FeCO3總反應的化學方程式_____________________;
(4)為防止鐵生銹,可對鐵制品進行“烤藍”處理,使其表面生成致密氧化物(其中Fe、O元素質量比為21: 8)保護膜,該氧化物的化學式為_____________________;
(二)廢鐵的再利用
硫酸鐵在農業可用作肥料,是花木,果樹制造葉綠素的催化劑。用廢鐵屑(主要成分為Fe,含少量Fe2O3和FeCO3)制備硫酸鐵的主要流程如下:
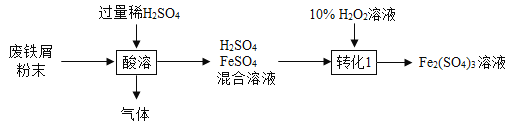
(1)將廢鐵屑研磨成粉末的目的是_____________________;
(2)“酸溶” 時H2SO4與FeCO3反應生成一種常見氣體,反應的化學方程式為_____。
(3)“轉化”過程中發生反應的化學方程式為_____________________。反應時溫度不宜過高的原因是_____________________;
(三) CH4還原Fe2O3的探究
取40.0gFe2O3粉末,用下圖裝置進行實驗,并對反應及產物等作探究。
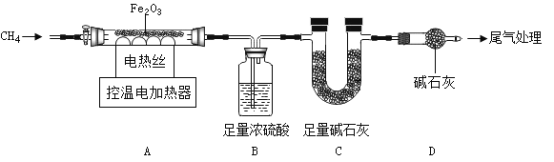
資料:①濃硫酸有吸水性,堿石灰可吸收H2O和CO2.②![]()
(I)裝配好實驗裝置后,先要_____________________;
(2) A中反應:![]() 。下列說法正確的是_____________________;(選填序號)。
。下列說法正確的是_____________________;(選填序號)。
a x:y=1:2
b 裝置B、C增加的質量比為9:11
(3)控溫加熱 一段時間后,繼續通CH4至冷卻,A中剩余的32.0g 固體為Fe和FeO的混合物。在剩余固體中加一定量稀硫酸溶液,反應剛好完全。
①剩余固體中FeO質量為_____________________g.
②剩余固體和稀硫酸完全反應形成FeSO4的質量為_____________________g.
查看答案和解析>>
科目: 來源: 題型:
【題目】某興趣小組的同學對錯的某些性質進行相關探究。
[提出問題]鋁能否與水反應生成氫氣?
物質 | 鈉與水 | 鋁與水 | 汞與水 |
能否發生反應 | 能反應 | 能反應 | 不反應 |
[查閱資料]如圖:
[交流與討論]
(1)鋁在空氣中與氧氣反應形成保護膜,寫出鋁與氧氣反應的化學方程式_____________________。
(2)要除去鋁表面氧化鋁薄膜,可以將鋁片漫入氯化汞( HgCl2)溶液中,形成鋁汞齊(鋁汞合金)破壞鋁表面致密的氧化膜且防止其重新生成。鋁與氯化汞溶液發生置換反應的化學方程式為______________________。
[實驗探究]
(1)將鋁片完全浸入氯化汞(HgCl2)溶液中1分鐘左右后取出。立即用水沖洗干凈后加入到蒸餾水中,表面生成大量氣泡,周圍出現白色沉淀。在導管口處涂肥皂水,發現有氣泡形成。用燃著的木條點燃氣泡,發出爆鳴聲,對應化學方程式為_____________________。
[實驗結論]鋁能與水反應生成氫氣。
請寫出鋁與水反應生成氫氧化鋁和氫氣的化學方程式_____________________。
[實驗反思]
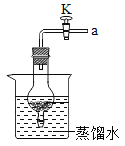
(1)若反應使用如圖裝置,關閉導管上的活塞K,反應停止,其原理是_____________________。當再次打開活塞K,反應繼續,產生氣泡。鋁未能生成氧化鋁,其原因是_____________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某金屬板中含Fe、Cu、Ni(鎳,銀白色金屬)等金屬和不溶于酸的雜質。下圖是回收金屬的流程。已知: ![]()

(1)操作①②③的名稱為______________________;此操作需用玻璃儀器有: 燒杯、______________________、玻璃棒。
(2)在濾渣①中加入稀硫酸,觀察到______________________;則證 明操作①中所加稀硫酸已過量。
(3) Cu、 Fe、 Ni的活動性由強到弱順序是_______________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖表示某些物質間轉化關系。G為常見金屬,E為赤鐵礦的主要成分: C、 F都是由相同元素組成的無色氣體,且C有毒: D、H都是無色氣體單質:反應⑤是自然界中最重要的反應。請回答下列問題:
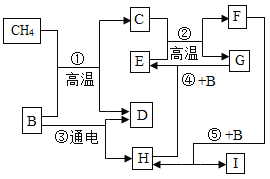
(1) B的化學式為_____________________;
(2)生活中為防止反應④的發生,可采取的措施是_____________________(寫一 點即可)
(3)自然界中普遍存在反應⑤,該反應通常被稱為_____________________;
(4)反應①的化學方程式為_____________________;反應②的化學方程式為_____________________;
(5)“綠色”特點之一是“零排放”。一定條件下, C和D兩種氣體可按照不同比例反應, 若只生成一種產物就能實現“零排放”,符合這一要求的產物是_____________________ (填字母) 。
A CH4O
B C2H6O
C C2H4O
D C2H4O2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com