
【題目】某食用堿的主要成分是Na2CO3,其中含有少量的NaCl,小明同學為測定該食用堿中Na2CO3的質量分數,他進行了以下實驗,取40 g食用堿,加水配成400g的溶液,把溶液平均分為四份,然后分別加入一定質量分數的CaCl2溶液,實驗數據見下表:
實驗一 | 實驗二 | 實驗三 | 實驗四 | |
食用堿溶液的質量 | 100g | 100g | 100g | 100g |
加入CaCl2溶液的質量 | 20g | 40g | 60g | 80g |
生成沉淀的質量 | 2.5g | 5g | m | 8g |
請分析表中數據并計算回答。
(1)m=________;
(2)40 g該食用堿配成的溶液與足量CaCl2溶液反應,最多生成沉淀質量為多少;
(3)該食用堿中Na2CO3的質量分數是?(寫出計算過程,答案精確到0.1%)
(4)請根據實驗四的數據畫圖并標上合適的坐標。
【答案】7.5 32 84.8% 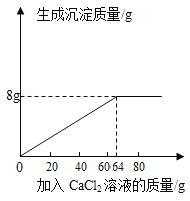
【解析】
(1)由實驗一與實驗二可知,每20g氯化鈣溶液反應后生成2.5g沉淀,則實驗三中60g氯化鈣反應后生成沉淀的質量為7.5g,小于第四次實驗中生成沉淀的質量,所以m的數值為7.5,故填7.5。
(2))由實驗一與實驗二可知,每20g氯化鈣溶液反應后生成2.5g沉淀,則實驗四中的氯化鈣完全反應后生成沉淀的質量應為10g,可實際生成沉淀的質量為8g,說明氯化鈣并沒有完全反應,則100g食用堿溶液完全反應,生成沉淀的質量為8g,則40g該食用堿配成的400g溶液如果與足量CaCl2溶液反應,最多生成沉淀質量為32g,故填32。
(3)解:設生成8g沉淀時參加反應的碳酸鈉的質量為x
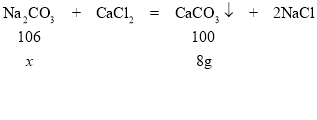
106:100=x:8g
x=8.48g
該食用堿中Na2CO3的質量分數=![]() ×100%≈84.8%
×100%≈84.8%
答:該食用堿中Na2CO3的質量分數是84.8%。
(4)解:由實驗一與實驗二可知,每20g氯化鈣溶液反應后生成2.5g沉淀,則生成8g沉淀時參加反應的氯化鈣的溶液的質量=8g×![]() =64g,所以生成沉淀的質量與參加反應的氯化鈣溶液的質量關系圖像為
=64g,所以生成沉淀的質量與參加反應的氯化鈣溶液的質量關系圖像為 ,故填
,故填 。
。


科目:初中化學 來源: 題型:
【題目】甲、乙、丙三種固體(均不含結晶水)的溶解度曲線如圖所示。
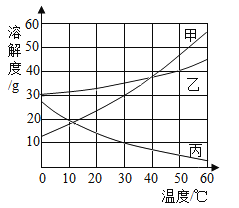
(1)20℃時,三種物質的溶解度由大到小依次為______________。
(2)30℃時,甲和乙的飽和溶液各100g兩種溶液中溶劑質量的大小關系:為甲___________乙填(<、>、=)。
(3)甲中含有少量的乙,提純甲的方法是______________。
(4)甲、乙、丙中的某一種固體進行如下所示的實驗。
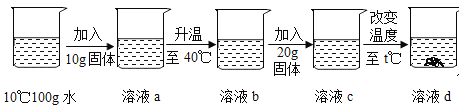
①溶液a的溶質質量分數是______________。(精確到0.1%)
②取用的固體是_____________;溫度t的范圍是______________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】請結合下列實驗裝置,回答有關問題。
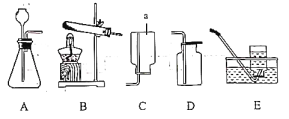
(1)寫出圖中儀器a的名稱:_____。
(2)實驗室用加熱氯酸鉀和二氧化錳的混合物制取并收集氧氣,選用的裝置為___(填字母),該反應的化學方程式為_____。
(3)實驗室用石灰石和稀鹽酸反應制取并收集二氧化碳,選用的裝置為__(填字母),該反應的化學方程式為___。
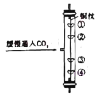
(4)如圖所示實驗中,①、④為用紫色石蕊溶液潤濕的棉球,②、③為用石蕊溶液染成紫色的干燥棉球,觀察到的現象是④比①先變紅,②、③不變紅,該實驗能說明二氧化碳_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】過氧乙酸(CH3CO3H)是一種光譜高效消毒劑,不穩定,常溫下易分解。制備過氧乙酸的化學方程式為: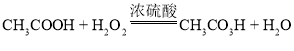 。取質量相等的乙酸(CH3COOH)和50% H2O2溶液均勻混合,再加入適量濃硫酸。一定條件下,測得溶液中過氧乙酸質量分數的數據如圖。下列說法不正確的是
。取質量相等的乙酸(CH3COOH)和50% H2O2溶液均勻混合,再加入適量濃硫酸。一定條件下,測得溶液中過氧乙酸質量分數的數據如圖。下列說法不正確的是
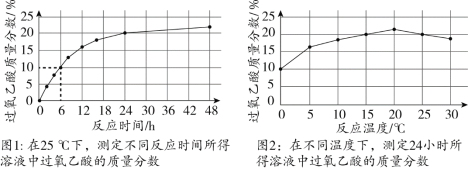
A.過氧乙酸中C、H元素的質量比為6:1
B.圖1中,反應時間為6 h時,若溶液總質量為100 g,其中含有10 g過氧乙酸
C.圖2中,與20℃相比,25℃時溶液中過氧乙酸質量分數下降的可能原因是溫度升高,過氧乙酸分解得更多
D.綜合圖1和圖2分析,制備過氧乙酸的最佳反應時間為24 h,最佳反應溫度為25℃
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列選用的除雜試劑和實驗操作都正確的是(括號內為雜質)
選項 | 物質 | 除雜選用的試劑和操作 |
A | NaCl固體(Na2CO3)固體 | 加入足量鹽酸,攪拌至充分反應,蒸發結晶 |
B | KCl固體(KClO3)固體 | 加入少量的MnO2,加熱 |
C | CO2(CO) | 通入足量氧氣,點燃 |
D | NaNO3溶液(NaOH溶液) | 加入適量CuSO4溶液,過濾 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】向甲、乙兩只燒杯中分別加入 100g 溶質質量分數為 7.3%的稀鹽酸,然后取等質量的鎂、鋁單質,分別放入甲、乙兩個燒杯中。充分反應后,發現甲燒杯中單質鎂有剩余, 則有關該實驗的說法正確的是( )
A.乙燒杯中單質鋁一定沒有剩余
B.鋁剩余的質量一定比鎂剩余的少
C.甲、乙燒杯中都產生了 0.2g 氫氣
D.反應結束后甲、乙燒杯中物質的質量相等
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】“他們創造了一個可再充電的世界”,2019年諾貝爾化學獎授予了斯坦利等三位科學家,以表彰他們在鋰離子電池領城的研發工作。下圖是鋰原子結構示意圖及其在元素周期表中的信息,據此判斷下列說法中錯誤的是( )

A.鋰元素屬于金屬元素
B.鋰原子的質子數為3
C.氫元素最外層電子數為1,所以鋰元素的化學性質與氫相似
D.鋰原子在化學反應中容易失去電子
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖中的A~E是初中化學實驗中常用的幾種裝置,按要求回答問題。
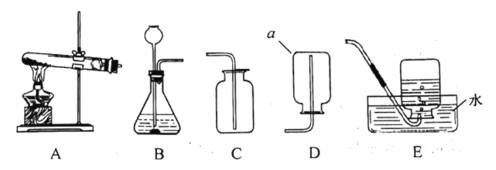
(1)寫出儀器a的名稱:______。
(2)若實驗室用高錳酸鉀制取氧氣,應選用的制備及收集的裝置為_____,該反應的化學方程式為_____。
(3)若實驗室用大理石和稀鹽酸制取二氧化碳,反應的化學方程式為_____。
(4)若用裝置E收集某氣體,當導管口開始有氣泡放出時,不宜立即收集,當氣泡_____的放出時,再開始收集氣體。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】實驗小組在探究“酸與堿能否發生反應”時,進行了如圖所示實驗。請根據實驗回答:
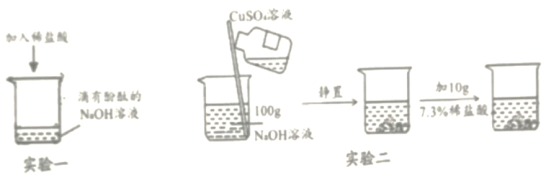
(1)甲同學進行了實驗一,能觀察到的明顯現象是__________,同時測定反應后溶液的pH=2,說明酸能與堿發生化學反應。
(2)乙同學進行了實驗二,當倒入CuSO4溶液觀察到現象是_________,再加入稀鹽酸,發現無明顯變化,于是得出“酸不一定能與堿反應”的結論。丙同學對此產生質疑,用pH試紙測定實驗二反應后混合物中上層清液pH=12,說明上層清液溶質中含有__________。你認為丙同學質疑乙同學結論的原因是________。
(3)丁同學利用上述實驗后的廢液繼續實驗。將實驗二反應后的混合物過濾,得濾渣和濾液。將濾渣分為兩等份,向一份濾渣中逐滴加入實驗一所得溶液,能說明酸與堿發生化學反應的現象是________,反應的化學方程式是________,將另一份濾渣洗滌、晾干、稱量,質量為0.98g.
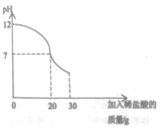
(4)戊同學向丁同學的濾液中繼續逐滴滴加質量分數為7.3%的稀鹽酸30g,同時用pH計測定并記錄反應過程中混合溶液pH變化情況(如圖所示)。乙同學所用NaOH溶液溶質的質量分數為_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com