
【題目】實驗室開放日,某化學興趣小組的同學在老師的指導下,設計了如下實驗裝置進行氣體制取的探究,回答問題:

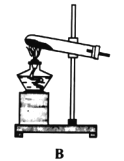

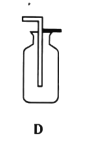
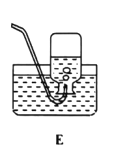
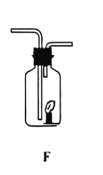
(1)實驗室用氯酸鉀制取氧氣的發生裝置是_____(填序號),該反應的化學方程式為_____.
(2)選擇氣體收集方法時,必須考慮的氣體性質有_____(填序號)。
①顏色 ②密度 ③溶解性 ④可燃性
(3)某同學連接A、F進行實驗,A中所加藥品不同。
①若實驗時F中蠟燭火焰熄滅,則A中反應的化學方程式為_____
②若實驗時F中蠟燭燃燒更旺,則A中反應的化學方程式為_____
【答案】B ![]() ②③ CaCO3+2HCl=CaCl2+H2O+CO2↑
②③ CaCO3+2HCl=CaCl2+H2O+CO2↑ ![]()
【解析】
實驗室制取氣體發生裝置的選擇主要看反應物的狀態(固態還是液態)和反應條件(是否需要加熱),將發生裝置分為固體加熱型裝置和固液混合不加熱型裝置;收集裝置主要根據生成氣體在水中的溶解性以及是否和水反應考慮能否用排水法,不易溶于水或不溶于水且不與水發生反應可以采用排水法收集,還可以根據氣體和空氣密度的比較以及是否和空氣中的各成分反應,判斷能否采用排空氣法收集,如果氣體密度和空氣密度非常接近則不適宜采用排空氣法,在使用排空氣法收集時,密度比空氣大的采用向上排空氣法,密度比空氣小的采用向下排空氣法收集。
(1)實驗室用氯酸鉀制取氧氣,反應物是固體,反應條件是加熱,發生裝置應選固體加熱型裝置,故填B,氯酸鉀在二氧化錳的催化和加熱條件下分解生成氯化鉀和氧氣,化學方程式故填:![]() ;
;
(2)由上分析可知根據氣體的密度和溶解性選擇氣體收集方法,必須考慮的氣體性質故填:②③;
(3)
①根據蠟燭火焰熄滅,說明生成的氣體不可燃不助燃,根據收集方法是長進短出說明密度比空氣大,則判斷生成的氣體是二氧化碳,A中反應的化學方程式故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②若實驗時F中蠟燭燃燒更旺,說明生成的氣體是氧氣,則A中反應的化學方程式故填:![]() 。
。


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:
【題目】金屬材料在國民生產和日常生活中得到普遍廣泛的應用
(1)用如圖所示實驗探究鐵生銹的條件(每支試管中均放有完全相同的潔凈鐵片);
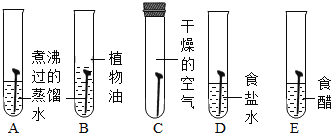
①甲同學認為,試管A發生的現象就能夠說明鐵的銹蝕是鐵與空氣中的氧氣、水蒸氣共同作用的結果。乙同學不同意他的觀點,認為必須全面觀察試管_______(選填試管編號)發生的現象,并經過科學嚴謹的推理,才能得出上述結論。B中植物油的作用是_______。
②試管D和E實驗的目的是進一步探究鐵在_______的環境中是否更容易銹蝕。
(2)黃銅(銅鋅合金)用作彈殼的制造。現有一批使用過的,銹跡斑斑的彈殼,處理這批彈殼可以制得硫酸鋅和銅,其主要流程如圖甲所示:
(收集資料)彈殼上的銹主要為Cu2(OH)2CO3,能與稀硫酸反應得到硫酸銅溶液;彈殼中其他雜質不溶于水,也不參加反應。
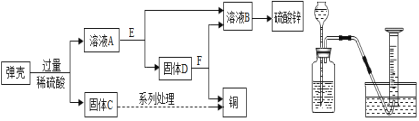
甲 乙
①寫出彈殼上的銹與稀硫酸反應的化學方程式_______。
②固體D為_______。從微觀的角度來看,A與E的反應微觀實質是_______。
(3)為了比較甲、乙兩種金屬的活動性強弱和相對原子質量大小,小昊設計了一套實驗裝置(如圖乙),他取兩種金屬各m克,分別加入足量的稀硫酸進行反應,在相同條件下測定不同時間內收集到的氣體體積,實驗記錄如表:
反應時間(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
收集到的氣體體積(毫升) | 甲金屬 | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
乙金屬 | 30 | 75 | 120 | 150 | 150 | 150 | 150 | |
①由實驗結果可知:金屬活動性較強的是_______。實驗中,除了要控制兩種金屬的質量相等,還需要控制的變量有_______。
②為了使得到的實驗數據準確,小昊開始收集氣體的時間點應該是_______(填字母)
A.導管口一有氣泡冒出時 B.冒出氣泡連續且均勻時C.檢驗產生的氣體純凈時
③根據已有實驗數據,要比較甲、乙兩種金屬的相對原子質量大小,還需知道的數據是______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】甲、乙、丙三種固體物質的溶解度曲線如圖所示,請回答:
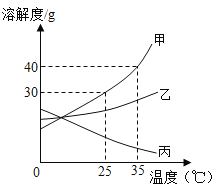
(1)25℃時,將25g甲固體加入到50g水中,充分溶解并恢復到原溫度后,得到溶液的質量為__g。
(2)要使35℃時接近飽和的乙溶液變成該溫度下的飽和溶液,可采用的一種方法是____。
(3)將35℃時丙的飽和溶液降溫到25℃,則其溶液的溶質質量分數____(填“變大”、“變小”或“不變”)。
(4)現有操作步驟:a.溶解 b.過濾 c.降溫結晶 d.加熱濃縮,甲固體中含有少量丙,則提純甲的操作步驟是___(填字母序號)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列化學方程式與對應反應類型均正確的是( )
化學方程式 | 反應類型 | |
A | H2O | 分解反應 |
B | 4Al+3O2=2Al2O3 | 化合反應 |
C | 2Fe+6HCl═2FeCl3 +3H2↑ | 置換反應 |
D | CO2 +2NaOH ═Na2CO3+H2O | 復分解反應 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】(7分)取氯酸鉀和二氧化錳的混合物26g,加熱至混合物固體質量不再減少為止,冷卻后稱得剩余固體質址為16 .4g ,將剩余固體加入一定量的水中,充分攪拌后過濾,濾液是10%的氯化鉀溶液(假設溶液無損失)。計算:
(1)生成氧氣的質量。
(2)二氧化錳的質量。
(3)氯化鉀溶液中水的質量。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】我國制堿工業的先驅候德榜發明了“侯氏制堿法”,其生產過程涉及的主要化學反應如下:
①![]()
②![]()
③![]()
計算:
(1)反應①中X的化學式為_____
(2)工業純堿中含有氯化鈉,取55g工業純堿,向其中加入269.5g稀鹽酸,恰好完全反應,生成22g二氧化碳,求:
①工業純堿中碳酸鈉的質量:_____
②反應后溶液中溶質的質量分數。_____
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】“高質發展,后發先至”是連云港新一輪發展的主線,我市瀕臨黃海,擁有豐富的海洋資源。
(1)食用海魚、海蝦等海鮮可為人體提供的營養素主要是_____(填序號)
A 糖類 B 蛋白質 C 維生素 D 油脂
(2)從海水中獲得粗鹽的方法是采用蒸發結晶,而不是降溫結晶,理由是_____;
(3)用氯化鈉固體配制 100g 質量分數為 10%的氯化鈉溶液。若測得所配制溶液的溶質質量分數偏小,其 原因可能是_____(填序號)。
A 氯化鈉固體不純 B 量取水時,俯視讀數
C 溶解時,燒杯內壁有水 D 裝瓶時,有少量溶液灑出
(4)某濃度的海水中主要離子的濃度如下:
離子 | Na+ | Mg2+ | Cl﹣ | SO 42﹣ |
濃度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
①從海水中提取 MgCl2,將 MgCl2 溶液在一定條件下蒸發結晶、熔融電解可制得金屬鎂,則 2L 該濃度的 海水理論上可得到金屬鎂的質量為_____g;
②將一定量的鎂粉加入到適量硝酸亞鐵和硝酸銀的混合溶液中,充分反應后過濾,得到濾液和濾渣。取少 量濾液,加入稀鹽酸溶液,無明顯現象,則濾液中一定沒有_____;取少量濾渣,加入足量稀鹽酸, 有氣泡產生,則濾渣中一定含有_____;
③凈化水常用的方法有沉降、過濾、吸附和蒸餾,活性炭在凈水器中能起到過濾和吸附的作用,這是由于 活性炭具有_____結構。
④電解水實驗揭示了水的組成(如下圖)。
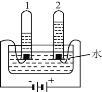
電解水的反應方程式為__________________, 實驗過程中可加入稀硫酸以增強導電性,實驗結束后,溶液 pH 將_______(填“增大”、 “減小”或“不變”)。
(5)常溫下,氯酸鉀的溶解度較小,在工業上可通過如下轉化制得。
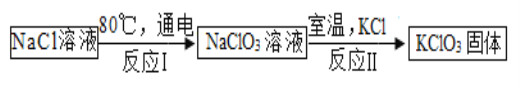
①實驗室用氯酸鉀制取氧氣的化學方程式為_____ ;
②反應Ⅰ中,是將_____能轉化成化學能;
③反應Ⅱ的基本反應類型為復分解反應,請寫出反應方程式_____;
④該工業轉化中可以循環利用的物質是_____ 。
查看答案和解析>>
科目:初中化學 來源: 題型:
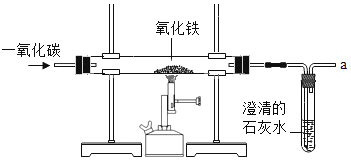
【題目】煉鐵的原理是利用一氧化碳與氧化鐵反應,某同學利用該原理設計了一個實驗,實驗裝置如圖:對實驗進行分析并回答:
(1)給玻璃管加熱的儀器叫酒精噴燈,要用其_____(填“外焰”“內焰”或“焰心”)進行加熱;
(2)實驗中玻璃管里氧化鐵粉末的顏色變化是_____,玻璃管中發生反應的化學方程式為_____;試管中觀察到的現象是_____;
(3)實驗前“①通入CO氣體”與“②開始給玻璃管加熱”的順序是_____(填序號,下同);實驗后“③停止通入CO氣體”與“④停止加熱”的順序是_____;
(4)實驗要在裝置末端a處燃著一盞酒精燈,其作用是_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com