
【題目】碘化鉀(KI)是白色固體,保存不當會被氧化為單質碘(I2)而泛黃變質。化學小組查得以下資料:
Ⅰ.對于碘化鉀變質的原理,有兩種不同的反應:
甲:4KI+O2+2CO2=2K2CO3+2I2
乙:4KI+O2+2H2O=4KOH+2I2
Ⅱ.KOH與NaOH的化學性質相似。
為探究碘化鉀變質原理的合理性,開展以下實驗。
(實驗過程)
[實驗1]取適量碘化鉀固體暴露于空氣中一段時間,觀察到固體泛黃。往泛黃的固體中加入足量稀硫酸,產生無色無味的氣體,通入澄清石灰水中,澄清石灰水變渾濁。
①石灰水變渾濁的原因是______(用化學方程式表示)。
②化學小組認為:據此現象,還不能得出“反應甲是造成碘化鉀變質的原因”的結論。理由是______。
[實驗2]如圖1所示裝置進行實驗,數日后,觀察到碘化鉀固體無泛黃現象。

③據此現象,可得出的結論是______。
[實驗3]按圖2所示裝置進行實驗,數日后,觀察到碘化鉀固體無泛黃現象。查閱文獻獲知,常溫下某些氣體和固體反應須在潮濕環境中進行。
化學小組據此改進實驗,很快觀察到固體泛黃的現象。
(實驗結論)④根據上述實驗,化學小組得出結論,碘化鉀固體泛黃變質是碘化鉀與______共同作用的結果。
【答案】![]() 無法判斷K2CO3是按反應甲原理產生的,還是按反應乙原理生成的KOH又與空氣中二氧化碳反應生成K2CO3 氧氣和水不能使碘化鉀變質 氧氣、水和二氧化碳
無法判斷K2CO3是按反應甲原理產生的,還是按反應乙原理生成的KOH又與空氣中二氧化碳反應生成K2CO3 氧氣和水不能使碘化鉀變質 氧氣、水和二氧化碳
【解析】
①二氧化碳能和石灰水反應生成不溶于水的碳酸鈣和水,這是石灰水變渾濁的原因,化學方程式為:![]() ;
;
②碘化鉀直接變質可以生成碳酸鉀,碘化鉀變質生成的氫氧化鉀,吸收二氧化碳也會生成碳酸鉀,通過澄清石灰水變渾濁的現象,不能判斷碳酸鉀是如何轉化成的,所以,理由是:無法判斷K2CO3是按反應甲原理產生的,還是按反應乙原理生成的KOH又與空氣中二氧化碳反應生成K2CO3;
③按如圖所示裝置進行實驗,數日后,觀察到碘化鉀固體無泛黃現象,可得出的結論是:氧氣和水不能使碘化鉀變質;
④根據上述實驗,化學小組得出的結論:碘化鉀固體泛黃變質是碘化鉀與氧氣、水和二氧化碳共同作用的結果。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源: 題型:
【題目】銅獅人類最早利用的金屬之一。
(1)“濕法煉銅”的原理是硫酸銅溶液與鐵反應,該反應的化學方程式為______________。
利用廢舊電池銅帽(含Cu、Zn)制取海綿銅(Cu),并得到硫酸鋅溶液,主要流程如下(反應條件己略去):已知:
2Cu+2H2SO4+O2![]() 2CuSO4+2H2O
2CuSO4+2H2O
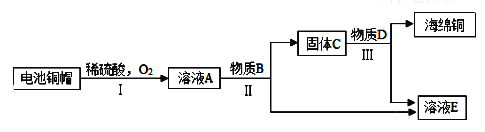
(2)①過程Ⅱ中分離操作的名稱是______.
②過程Ⅲ中有氣體產生,反應的化學方程式為______.
③A~E中含銅、鋅兩種元素的物質有______(填字母序號).
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖所示,若向小試管(試管中裝有水)中分別加入一定量的下列物質,U型管中的液面左升右降,則該物質是( )
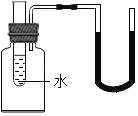
A. 濃硫酸B. 硝酸銨固體C. 氧化鈣固體D. 氯化鈉固體
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖表示的是甲、乙兩種物質的溶解度曲線,據圖所示,下列說法正確的是( )
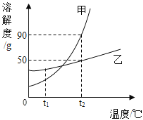
A. t2℃時,甲乙兩物質飽和溶液中的溶質質量大小關系是甲>乙
B. 若甲物質中混有少量的乙物質,可以采用降溫結晶的方法提純甲物質
C. t2℃時將30g乙物質加入到50g水中,所得溶液的質量為80g
D. 將t1℃的甲、乙兩物質的飽和溶液(均無固體物質剩余)升溫到t2℃時,溶液中的溶質質量分數大小關系是甲>乙
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖表示的是甲、乙兩種物質的溶解度曲線,據圖所示,下列說法正確的是( )
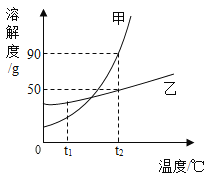
A. t2℃時,甲乙兩物質飽和溶液中的溶質質量大小關系是甲>乙
B. 若甲物質中混有少量的乙物質,可以采用降溫結晶的方法提純甲物質
C. t2℃時將30g乙物質加入到50g水中,所得溶液的質量為80g
D. 將t1℃的甲、乙兩物質的飽和溶液(均無固體物質剩余)升溫到t2℃時,溶液中的溶質質量分數大小關系是甲>乙
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】2019年1月3日,嫦娥四號探測器在人類史上第一次實現了月球背面著陸。在月球廣泛分布的巖石中,蘊藏著豐富的鈦、鎳等礦產。元素周期表中鈦、鎳兩種元素的相關信息如圖所示,對圖中信息解釋不正確的是( )
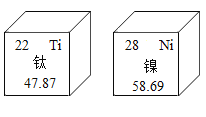
A. 鈦、鎳均屬于金屬元素
B. 鈦原子核內中子數為22
C. 鎳原子核外電子數為28
D. 鎳原子的相對原子質量為58.69
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某研究性小組的同學用氫氧化鈣溶液和鹽酸進行酸堿中和反應的實驗時,向燒杯中的稀鹽酸加入氫氧化鈣溶液一會兒后,發現忘記滴加指示劑,因此,他們停止滴加氫氧化鈣溶液,并對燒杯內溶液中的溶質成分進行探究
(提出問題)該燒杯內溶液中的溶質是什么?
(提出猜想)猜想①:可能是CaCl2和Ca(OH)2;猜想②:_____猜想③可能是CaCl2和HCl
(查閱資料)氯化鈣溶液呈中性。
(實驗探究)
實驗步驟 | 實驗現象 | 結論 |
取少量燒杯內溶液于試管中,滴入幾滴酚酞溶液 | _____ | 猜想①不成立 |
取少量燒杯內溶液于試管 中逐滴加入Na2CO3溶液 | _____ | 猜想②成立 |
_____ | 猜想③成立 |
(反思)(1)在分析化學反應后所得物質成分時,除考慮生成物外還需要考慮_____。
(2)若猜想③正確,要處理燒杯內溶液使其溶質只含有CaCl2,應向燒杯中加入過量的_____(化學式)。
(3)驗證燒杯內溶液中的溶質含有HCl,除以上方案外,下列哪些物質或者方法單獨使用也能完成該實驗_____?
A.pH試紙 B.鎂條 C.檢查導電性 D.銅片
(拓展延伸)(注意:若答對(拓展延伸)獎勵4分,化學試卷總分不超過60分。)
(1)在進行酸堿中和反應實驗的過程中,研究性小組取一定量的稀鹽酸,逐滴勻速滴加氫氧化鈣溶液,用pH和溫度電子傳感器實時獲得的pH、溫度曲線(如圖),由圖你得到的認識,
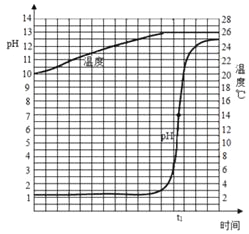
請寫出兩條①_____②_____。
(2)微粒觀是化學基本觀念的重要組成部分,也是化學基本觀念中最基礎的部分,從微觀視角認識和考察物質世界是研究化學應掌握的重要思維方法,試從微觀角度分析酸堿中和反應的實質是_____。由中和反應實質可以知道部分離子在水溶液中不能共存,請再寫出一組不能共存的離子_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】工業廢料石膏![]() 可以“變廢為寶”,用于生產氧化鈣、硫酸鉀、電石等。某研究性學習小組展開了如下系列研究:
可以“變廢為寶”,用于生產氧化鈣、硫酸鉀、電石等。某研究性學習小組展開了如下系列研究:
一、高純CaO的制備
(資料一)
Ⅰ![]() 無水硫酸銅遇水變成藍色的硫酸銅晶體。
無水硫酸銅遇水變成藍色的硫酸銅晶體。
Ⅱ![]() 石膏
石膏![]() 與碳粉高溫煅燒生成氧化鈣和幾種氣態非金屬氧化物。
與碳粉高溫煅燒生成氧化鈣和幾種氣態非金屬氧化物。
Ⅲ![]() 能使品紅溶液褪色,也能使澄清石灰水變渾濁,還能被高錳酸鉀溶液氧化而除去。
能使品紅溶液褪色,也能使澄清石灰水變渾濁,還能被高錳酸鉀溶液氧化而除去。
甲同學用如下裝置制備CaO并驗證石膏與焦炭高溫反應的其他產物。
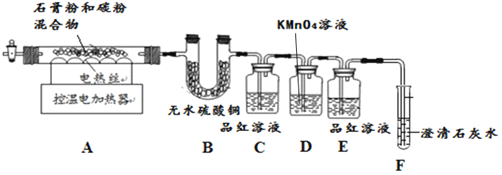
實驗過程中發現:B中無水硫酸銅變藍,說明有______生成;C中產生溶液褪色現象證明有![]() 生成;裝置______中無明顯變化和裝置F中______現象證明有
生成;裝置______中無明顯變化和裝置F中______現象證明有![]() 生成。寫出石膏與碳粉在高溫條件下反應的化學方程式:______。
生成。寫出石膏與碳粉在高溫條件下反應的化學方程式:______。
二、硫酸鉀和電石的制備
乙同學模擬生產化肥硫酸鉀和電石的流程如下:
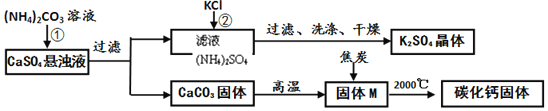
(資料二)常溫下,![]() 能溶于水,溫度升高,溶解度變大;
能溶于水,溫度升高,溶解度變大;
氧化鈣與焦炭在高溫下反應生成碳化鈣和一氧化碳。
![]() 反應
反應![]() 的化學方程式為______。證明固體M中不含
的化學方程式為______。證明固體M中不含![]() 的方法是______
的方法是______![]() 寫出實驗的方法、現象
寫出實驗的方法、現象![]() 。
。
![]() 反應
反應![]() 的化學方程式為
的化學方程式為![]() ,為得到純凈的硫酸鉀晶體,洗滌反應
,為得到純凈的硫酸鉀晶體,洗滌反應![]() 所得晶體是必不可少的步驟。但工業上不用水而用飽和
所得晶體是必不可少的步驟。但工業上不用水而用飽和![]() 溶液洗滌反應
溶液洗滌反應![]() 所得晶體,其目的是______。
所得晶體,其目的是______。
三、研究![]() 加熱分解的產物
加熱分解的產物
![]() 工業廢料
工業廢料![]() 中含有
中含有![]() ,為了測定
,為了測定![]() 和
和![]() 的質量比x:y,實驗小組利用如下圖所示的裝置
的質量比x:y,實驗小組利用如下圖所示的裝置![]() 夾持儀器省略
夾持儀器省略![]() 進行實驗:
進行實驗:
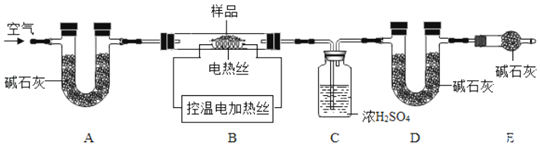
(資料三)堿石灰為固體氫氧化鈉和氧化鈣的混合物。可吸收水蒸氣或二氧化碳。
![]() 實驗前首先要______,再裝入樣品。裝置A的作用是______。
實驗前首先要______,再裝入樣品。裝置A的作用是______。
![]() 已知
已知![]() 在
在![]() 生成
生成![]() ,
,![]() 時
時![]() 開始分解;
開始分解;![]() 在
在![]() 時分解完全。現控制B裝置溫度
時分解完全。現控制B裝置溫度![]() 進行實驗并采集了如下數據:
進行實驗并采集了如下數據:
![]() 反應前玻璃管與樣品的質量m1g
反應前玻璃管與樣品的質量m1g![]() 反應后玻璃管中固體的質量為m2g
反應后玻璃管中固體的質量為m2g
![]() 裝置C實驗后增重m3g
裝置C實驗后增重m3g![]() 裝置D實驗后增重m4g
裝置D實驗后增重m4g
某同學選用c、d數據組合求出x:y的值,若無裝置E,則實驗測定結果將______![]() 填“偏大”、“偏小”或“無影響”
填“偏大”、“偏小”或“無影響”![]() 。
。
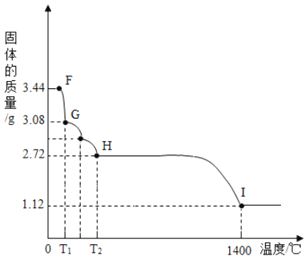
![]() 受熱會逐步失去結晶水。
受熱會逐步失去結晶水。
取純凈![]() 固體
固體![]() ,放在
,放在![]() 的實驗裝置B中進行加熱,測定固體質量隨溫度的變化情況如圖所示。
的實驗裝置B中進行加熱,測定固體質量隨溫度的變化情況如圖所示。![]() 點固體的化學式是______。請寫出計算過程。
點固體的化學式是______。請寫出計算過程。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】硫酸在工業上有著重要的用途。以黃鐵礦(主要成分為FeS2)為原料生產硫酸的原理及工藝流程可簡示如下:FeS2![]() SO2
SO2![]()
![]() H2SO4
H2SO4
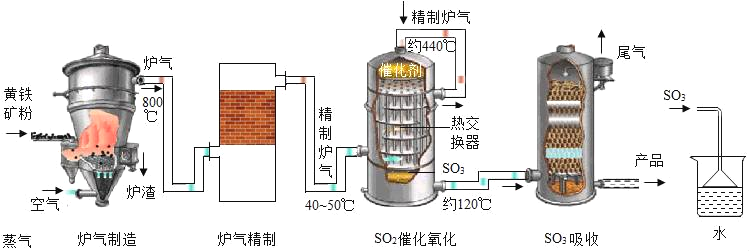
(1)工業生產過程中將礦石粉碎以及在吸收裝置中液體由上而下形成噴霧狀的目的是_____。
(2)在實驗室模擬制硫酸時用如圖裝置吸收三氧化硫,除了達到與工業上相同的目的外,還可能考慮的因素是_____。
(3)工業上常用熟石灰來吸收尾氣中的二氧化硫,請寫出反應的化學方程式_____。(提示:生成物有一種是CaSO3)
(4)實驗室中常用濃硫酸來配制稀硫酸。稀釋時,正確操作是,_____,并用玻璃棒不斷攪拌。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com